
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A. | ③④ | B. | ①③④ | C. | ②⑤ | D. | ②③⑤ |
分析 根据表中排布可知,每4个为一组,第一组碳原子为数为1,分别符合通式CnH2n+2、CnH2nO、CnH2nO2、CnH2n+2O,第二组碳原子为数为2,分别符合通式CnH2n+2、CnH2nO、CnH2nO2、CnH2n+2O,所以按此规律排布的第23项是第6组中的第三个,分子式为C6H12O2,以此解答该题.
解答 解:由表中排布可知,每4个为一组,第一组碳原子为数为1,分别为甲烷、甲醛、甲酸、甲醇,第二组碳原子为数为2,分别为乙烷、乙醛、乙酸、乙醇,所以按此规律排布的第23项是第6组中的第三个,分子式为C6H12O2,
可以是己酸,也可以是戊酸甲酯,戊酸甲酯在稀硫酸中易发生水解,与钠不反应,
所以正确的是①③④,错误的为②⑤,
故选C.
点评 本题主要考查有机物的结构和性质,侧重于学生的分析能力的考查,题目难度中等,注意掌握常见有机物结构与性质,根据排布规律推导出X的分子式是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
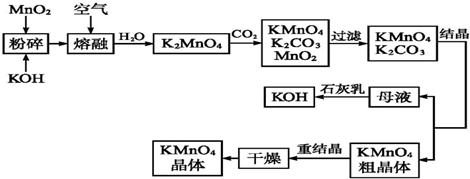
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ;⑦
;⑦ 和
和 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
 .
. 键和π键数目之比为1:1.
键和π键数目之比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 有关信息 |
| A | 位于第二周期第 VIA族 |
| B | 焰色反应呈黄色 |
| C | 无机非金属材料的主角 |
| D | 与A同主族 |
| E | 原子序数比D多1 |
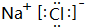 ,该化合物含有离子键(填“离子键”或“共价键”).
,该化合物含有离子键(填“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com