
| 弱酸 | H2CO3 | 水杨酸(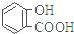 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 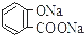 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 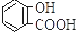 +2NaHCO3→ +2NaHCO3→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
分析 依据电离平衡常数比较形成盐的水解程度判断溶液酸碱性;酸性:水杨酸羧基酸性>H2CO3>HCO3->酚氧基,酸越弱形成盐的水解程度越大,
A.酸越弱,对应的酸根离子越容易水解,羧基水解程度小于碳酸氢根离子,据此判断两溶液的pH大小;
B.碳酸根离子水解程度大于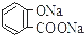 的水解程度,且碳酸根离子为二元弱酸根离子,而
的水解程度,且碳酸根离子为二元弱酸根离子,而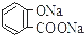 的酸根离子都是一元的,据此判断溶液中离子总数大小;
的酸根离子都是一元的,据此判断溶液中离子总数大小;
C.酚羟基的酸性小于碳酸,酚羟基不与碳酸氢根离子反应;
D. 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.
解答 解:A.羧基水解程度小于碳酸氢根离子,常温下,等浓度、等体积的NaHCO3溶液pH大于 溶液pH,故A错误;
溶液pH,故A错误;
B.碳酸根离子水解程度大于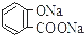 的水解程度,且碳酸根离子为二元弱酸根离子,而
的水解程度,且碳酸根离子为二元弱酸根离子,而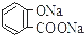 的酸根离子都是一元的,故等浓度、等体积的Na2CO3溶液和
的酸根离子都是一元的,故等浓度、等体积的Na2CO3溶液和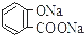 溶液中所含离子总数前者大于后者,故B错误;
溶液中所含离子总数前者大于后者,故B错误;
C.酚羟基的酸性小于碳酸,酚羟基不与碳酸氢根离子反应,只有羧基和碳酸氢钠溶液反应,故C错误;
D. 中形成分子内氢键,使其更难电离出H+,故相同温度下电离平衡常数Ka2<Ka1,故D正确;
中形成分子内氢键,使其更难电离出H+,故相同温度下电离平衡常数Ka2<Ka1,故D正确;
故选D.
点评 本题考查了弱电解质的电离、盐的水解原理及其影响等知识,题目难度中等,注意掌握弱电解质的电离平衡、盐的水解原理及其影响因素,试题充分考查了学生的分析、理解能力.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 以上四种元素的原子半径大小为WXYZ | |
| B. | X的氢化物与水分子之间可形成氢键 | |
| C. | 已知Z-Cl键能比X-Cl键能小,所以Z的最简单氯化物比X的最简单氯化物沸点低 | |
| D. | W与Y可形成既含共价键又含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
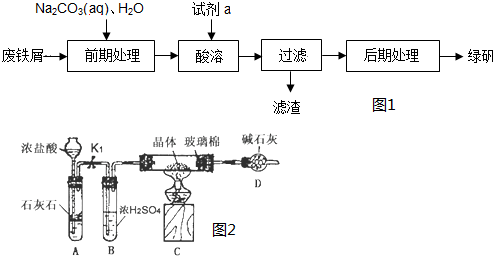
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
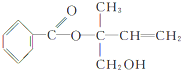 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 核外电子总是先排在能量低的电子层上 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O=Ag(NH3)2++2H2O | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O=NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 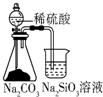 用如图可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 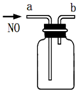 用如图装置收集一瓶纯净的NO | |
| C. |  用如图装置中U型管两端有液面差且保持不变时证明装置不漏气 | |
| D. | 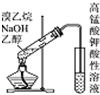 用如图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com