分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应:
Ⅰ.SO
2+2H
2O+I
2→H
2SO
4+2HI;
Ⅱ.2HI?H
2+I
2;
Ⅲ.2H
2SO
4→2SO
2+O
2+2H
2O.
(1)分析上述反应,下列判断正确的是
.
a.反应III易在常温下进行
b.反应I中SO
2还原性比HI强
c.循环过程中需补充H
2O
d.循环过程中产生1molO
2的同时产生1molH
2(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H
2物质的量随时间的变化如图所示.0-2min内的平均反应速率v(HI)=
.该温度下,反应2HI(g)?H
2(g)+I
2(g)的平衡常数表达式为K=
.相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍.
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H
2的体积分数
(3)SO
2在一定条件下可氧化生成SO
3,其主反应为:2SO
2(g)+O
2(g)?2SO
3(g)+Q,若此反应起始的物质的量相同,则各关系图正确的是
(填序号).
a、

b、

c、

d、

(4)实际生产用氨水吸收SO
2生成亚硫酸的铵盐.现取a克该铵盐,若将其中的SO
2全部反应出来,应加入18.4mol/L的硫酸溶液的体积范围为
.

 分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应:
分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应: b、
b、
 d、
d、


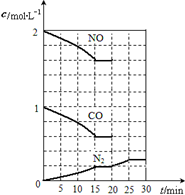 在铂-铑“三效”催化剂作用下,以下反应可以将汽车尾气中2种有
在铂-铑“三效”催化剂作用下,以下反应可以将汽车尾气中2种有