
| A. | 能够发生化学反应的碰撞是有效碰撞 | |
| B. | 增大浓度会加快化学反应速率,其原因是增加了单位体积内活化分子的数目 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7kJ•mol-1,若将含0.5 molH2SO4的稀硫酸与含0.5molBa(OH)2的溶液混合,放出的热量大于53.7kJ | |
| D. | 若化学平衡正向移动,则反应物的转化率会增大,平衡常数也必发生变化 |
分析 A.只有发生有效碰撞才能发生化学反应;
B.如活化分子百分数不变,则浓度增大,单位体积的活化分子的数目增多;
C.硫酸和氢氧化钡反应生成水的同时生成硫酸钡沉淀;
D.如温度不变,则平衡常数不变.
解答 解:A.活化分子之间发生化学反应的碰撞为有效碰撞,故A正确;
B.浓度增大,活化分子的浓度也增大,则单位体积的活化分子的数目增多,故B正确;
C.硫酸和氢氧化钡反应生成水的同时生成硫酸钡沉淀,则放出的热量大于53.7kJ,故C正确;
D.平衡常数只受温度的影响,如温度不变,则平衡常数不变,故D错误.
故选D.
点评 本题考查活化能及其对反应速率的影响,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意活化分子、有效碰撞以及活化能等概念的理解.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:解答题
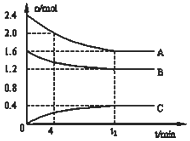 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 148g•mol-1 | B. | 100g•mol-1 | C. | 90g•mol-1 | D. | 38g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol•L-1 | |
| B. | 饱和氯水中:c(Cl-)=c(ClO-)+c(HClO) | |
| C. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
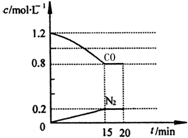 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.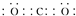 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com