
| A. | ①②④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
科目:高中化学 来源: 题型:解答题
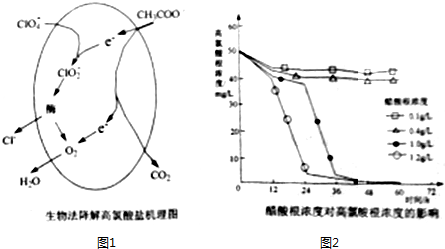
| 酸 | HClO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 1.6×10-9 | 4.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.
(1)某同学用碳棒,铜棒,稀硫酸和干电池为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑请在右边画出能够实验这一反应的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
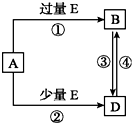
| A. | ②③④⑤ | B. | ①③④⑤⑥ | C. | ①②③⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
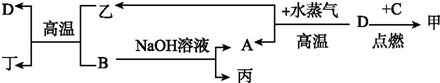
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车 | |
| B. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硅是一种酸性氧化物,它不跟任何酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
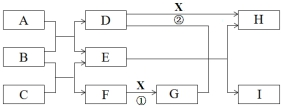
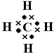 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com