
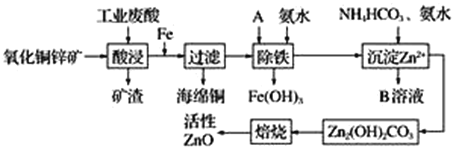
【题目】某科研小组设计出利用工业废酸(稀硫酸)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示。
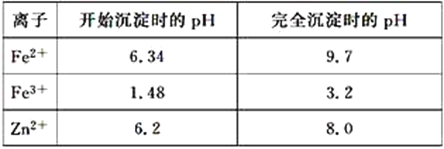
已知:各离子开始沉淀及完全沉淀时的pH如表所示:
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是(任写一点即可)____。
(2)物质A最好使用下列物质中的___(填选项序号)。
A.KMnO4 B.H2O2 C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在____范围之间,写出生成氢氧化铁的离子方程式:_____。
(4)物质B可直接用作氮肥,则B的化学式是____。
(5)除铁后得到的氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化得到一种高效的多功能处理剂(K2FeO4),写出该反应的离子方程式:____。
【答案】加热升高温度,或增大酸的浓度、将氧化铜锌矿粉碎等 B 3.2~6.2 2Fe2++4NH3H2O+H2O2=2Fe(OH)3↓+4NH4+ (NH4)2SO4 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
氧化铜锌矿经废酸浸取后过滤,可以得到硫酸铜、硫酸锌溶液;向酸浸溶液中加铁可还原出铜,经过滤可得到铜和硫酸亚铁、硫酸锌的混合液;然后加入A和氨水,将亚铁离子转化为氢氧化铁沉淀而除去;后向滤液中加入氨水将锌离子转化为氢氧化锌,最后焙烧,碱式碳酸锌受热分解得到氧化锌,据以上分析进行解答。
(1)影响化学反应速率的因素很多,要提高氧化铜矿的酸浸速率,可采用的措施:升高温度、增大酸的浓度、将矿石粉碎等;
故答案是:加热升高温度,或增大酸的浓度、将氧化铜锌矿粉碎等;
(2)除铁过程中加入A和氨水,使亚铁离子变为氢氧化铁沉淀,故A应为氧化剂;且考虑加入A不引入新杂质,KMnO4做氧化剂引入杂质锰离子,HNO3做氧化剂的还原产物对环境有危害,还引入杂质硝酸根离子,而双氧水的还原产物为水,不引入新杂质,绿色的氧化剂;
故答案选B。
(3)从图表中数据可知,铁离子沉淀完全的pH为3.2,锌离子开始沉淀的pH为6.2,故除去铁的pH应控制在3.2~6.2 范围之间;硫酸亚铁溶液中加入双氧水、氨水后,发生氧化还原反应,生成氢氧化铁沉淀,离子方程式为:2Fe2++4NH3H2O+H2O2=2Fe(OH)3↓+4NH4+;
故答案是:3.2~6.2;2Fe2++4NH3H2O+H2O2=2Fe(OH)3↓+4NH4+;
(4)因为所用废酸为硫酸,B又可做氮肥,所以B为(NH4)2SO4;
故答案是:(NH4)2SO4;
(5)根据信息可知,氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化为K2FeO4,反应的离子方程式:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
故答案是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为____,并写出其所有可能的结构简式:________。
(2)某烃在O2中完全燃烧,生成6.6 g CO2和3.6 g H2O,在标准状态下该烃的密度为1.964 3 g·L1,则其化学式为_______。
(3)某烷烃的相对分子质量为128,该烷烃的化学式为_______。
(4)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气的混合气体在点燃完全反应后再恢复到原来的温度时,气体体积缩小了,则该烃分子内的氢原子个数___(填序号)。
A.小于4 B.大于4 C.等于4 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
芳香烃A可以合成扁桃酸,也可以合成H。以下是合成线路(部分产物、反应条件已略去):

已知:
I、
II、![]()
III、
IV、D的相对分子质量为137,且在苯环的对位上有两个取代基
V、E为一溴取代物
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是 ________;物质B的结构简式 ________。
(2)上述①~⑥反应中属于取代反应的是 ________(填序号)。
(3)关于H物质,下列说法正确的是 ________ (填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H与G都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式 ________。
(5)X是扁桃酸的同分异构体,1 mol X可与2 mol Na2CO3反应,其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,其结构简式为 ________ (任写两种)。
(6)请结合所学知识和上述信息,写出由A和乙醛为原料(无机试剂任用)制备肉桂醛(![]() )的合成路线流程图 ________。
)的合成路线流程图 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B. 浓硫酸与单质硫反应的化学方程式:S+2H2SO4(浓)![]() 3SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C. 常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化
D. 把足量铜粉投入到含2molH2SO4的浓硫酸中,得到气体体积在标准状况下为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
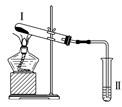
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用下图所示装置快速制取氨并验证氨的某些性质,同时收集少量纯净的氮气,请回答。
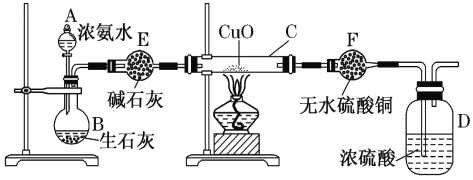
(1)写出用生石灰和浓氨水反应制氨的化学方程式____________________________,解释放出NH3的原因_______________________________________________________。
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管口处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃管内发生反应的化学方程式:___________________________________,
(3)在最后的出气导管口处收集干燥、纯净的氮气,收集方法是________。
A.排空气法 B.排水法 C.用气囊收集
(4) E中的碱石灰________(填“能”或“不能”)换成CaCl2。
(5) 在浓硝酸中放入铜片,若铜有剩余,开始反应的化学方程式为 __________________,
(6) 若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生NO和NO2 气体V L(标准状况),将产生的气体与一定量的氧气混合恰好被一定量的NaOH溶液吸收生成硝酸盐,则通入氧气的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图,下列说法中不正确的是 ( )
![]()
A. 它的分子式为C12H4O2Cl4B. 它不能发生加成反应
C. 它的一溴取代物有一种D. 此分子中共平面的原子最多有22个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com