
| A、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) | ||
| B、在0.1mol?L-1 的NaHA溶液pH=4,则H2A为强酸 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色 | ||
D、向0.1mol?L-1的氨水中加少量硫酸铵固体,则溶液中
|
| c(OH-) |
| c(NH3?H2O) |


科目:高中化学 来源: 题型:
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用HNO2溶液做导电性试验灯光较暗 |
| B、HNO2是共价化合物 |
| C、常温下,0.1 mol/L HNO2溶液的pH为2.2 |
| D、HNO2溶液不与NaCl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
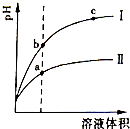 某温度下,相同pH值的盐酸和醋酸溶液,pH值随溶液体积变化的曲线如图,据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液,pH值随溶液体积变化的曲线如图,据图判断正确的是( )| A、Ⅱ为盐酸稀释时pH值变化曲线 |
| B、a点Kw的数值比c点Kw的数值大 |
| C、b点溶液的导电性比c点溶液的导电性强 |
| D、b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
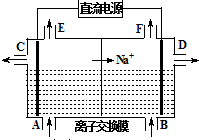 电解原理在工业生产中有广泛的应用.
电解原理在工业生产中有广泛的应用.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 0min | 2min | 4min | 6min | 8min | 10min |
| Z的浓度mol/L | 0 | 0.8 | 1.2 | 1.4 | 1.4 | 1.4 |
| A、用Y来表示0-4min的平均反应速率为0.15mol/(L?min) |
| B、该温度下反应的化学平衡常数为18.15 |
| C、向平衡体系中再加入2molX和1mol Y,达到新的平衡时X的体积分数增大 |
| D、对平衡体系降低温度,化学反应后速率减慢,但Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
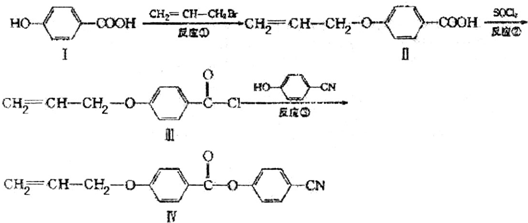
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com