
【题目】某同学设计了一组电化学装置如图所示,其中乙装置中 X 为阳离子交换膜,甲醇(CH3OH)具有可燃性。
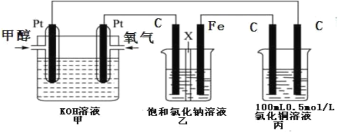
根据要求回答相关问题:
(1)写出装置甲中负极的电极反应式:________。
(2)装置乙中石墨电极(C)的电极反应式为:_________。
(3)当装置甲中消耗 0.05molO2 时,丙装置中阳极产生气体的体积 ____________L(标况下);
(4)若按(3)数据,装置乙中溶液的 pH 为_____________(溶液体积为 200mL 不变)。要使乙中溶液恢复到原来的状态,需要加入的物质是__________,对应用量为___________mol.
【答案】CH3OH6e+8OH═CO32+6H2O 2Cl2e=Cl2↑ 1.68 14 HCl 0.2
【解析】
(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为:CH3OH6e+8OH═CO32+6H2O,正极发生还原反应,电极方程式为O2+2H2O+4e═4OH;
故答案为:CH3OH6e+8OH═CO32+6H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl2e═Cl2↑;
故答案为: 2Cl2e=Cl2↑;
(3)当装置甲中消耗0.05molO2时,由电极方程式O2+2H2O+4e═4OH可知转移0.2mol电子,装置丙中阳极电极反应为:2Cl2e=Cl2↑,4OH4e=2H2O+O2↑,氯化铜物质的量n=0.1L×0.5mol/L=0.05mol,n(Cl)=0.1mol,生成氯气电子转移0.1mol,生成氯气物质的量0.05mol,则氢氧根离子电解反应电子转移0.1mol,生成氧气0.025mol,生成气体物质的量=0.05mol+0.025mol=0.075mol,标准状况下气体体积=0.075mol×22.4L/mol=1.68L;
故答案为:1.68;
(4)装置乙中阴极发生2H2O+2e=H2+2OH,可知生成0.2molOH,溶液体积为200mL,则c(OH)=1mol/L,则pH=14。
若复原至原状态,需HCl气体0.2mol;
故答案为:14;HCl; 0.2。


科目:高中化学 来源: 题型:
【题目】向含有KIO3的淀粉溶液中逐滴加入KHSO3溶液。下列说法中错误的是
A.早期滴加KHSO3溶液时发生的反应:![]() +
+![]()
![]()
![]() +I2+3H++H2O
+I2+3H++H2O
B.滴加一定量的KHSO3溶液后,溶液中可能同时含有I-和![]()
C.后期滴加KHSO3溶液,溶液中的反应为:![]() +I2+H2O
+I2+H2O![]()
![]() +2I-+3H+
+2I-+3H+
D.在不断滴加KHSO3溶液的过程中,溶液先变蓝,最终蓝色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.8×10-10mol2/L2,Ksp(AgI)=1.0×10-16 mol2/L2。下列说法中正确的是
A. 在相同温度下AgCl的溶解度小于AgI的溶解度
B. AgCl和AgI都不溶于水,因此AgCl和AgI不能相互转化
C. 常温下,AgC1若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol/L
×10-11mol/L
D. 将足量的AgCl分别放入下列物质中:①20mL0.01mol/LKCl溶液 ②10mL0.02mol/LCaCl2溶液 ③30mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的顺序为: ③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连物化所CO2催化转化为CO的研究获得新成果。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化。下列说法不合理的是( )
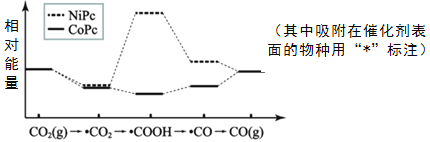
A.转化过程中有极性键形成
B.*CO2经氧化反应得到*COOH
C.吸附在NiPc和CoPc表面带有相同基团的物种其能量不同
D.该研究成果有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各种化学键如图所示。下列有关反应断键位置说明错误的是( )
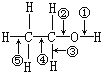
A.乙醇和浓硫酸,共热到170℃时断键②⑤
B.乙醇和浓硫酸,共热到140℃时断键①④
C.乙醇和金属钠的反应断键①
D.乙醇在Cu催化下与O2反应时断键①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因__。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__。
实验二:测定Na2CS3溶液的浓度
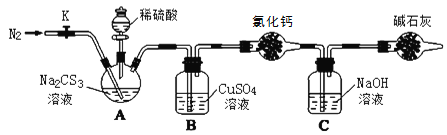
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞。
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL-1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放碱石灰的仪器的名称是__,碱石灰的主要成分是__(填化学式)。
(4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是_。
(5)C中发生反应的离子方程式是__。
(6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为__。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙红色)+H2O。下列说法正确的是
Cr2O72-(橙红色)+H2O。下列说法正确的是
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
D. 增大CrO42-浓度,平衡向右移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”,
已知:①Cu2++4NH3H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂)。
②已知仪器A、C溶液中硫酸浓度相同,实验中所用锌粒完全相同
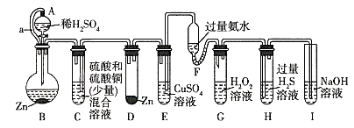
下列有关分析错误的是( )
A.该实验成功的重要条件是整套装置气密性良好
B.B中反应速率大于D中反应速率
C.A和B之间导管a的作用是平衡A和B内气压
D.H中出现浅黄色浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com