
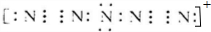 .
.分析 (1)结合题目中给出的信息H+结合能力大于NH3分子的结合能力,所以要想转化为自由的Ag+,应加入H+,但注意不能用盐酸和硫酸,因为其中的阴离子可以使Ag+沉淀;
(2)NO和NO2的混合气体中通入一定量的O2,混合气体被水完全吸收又转化为硝酸,纵观整个过程,Cu失去电子等于氧气获得的电子;
(3)依题干信息,将分子中原子排成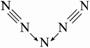 ,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构;
,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构;
(4)发生反应:2H2(g)+O2(g)$\frac{\underline{\;点燃\;}}{\;}$2H2O(g),反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,进而计算0.1mol 氢气反应放出的热量;
(5)根据化合价代数和为0计算R元素最高正化合价,最低负化合价=最高正化合价-8,进而书写氢化物化学式.
解答 解:(1)结合题目中给出的信息H+结合能力大于NH3分子的结合能力,所以要想转化为自由的Ag+,应加入H+,但注意不能用盐酸和硫酸,因为其中的阴离子可以使Ag+沉淀,可以加热硝酸,反应离子方程式为:[Ag(NH3)2]++2H+=Ag++2NH4+,
故答案为:硝酸;[Ag(NH3)2]++2H+=Ag++2NH4+;
(2)NO和NO2的混合气体中通入一定量的O2,混合气体被水完全吸收又转化为硝酸,纵观整个过程,Cu失去电子等于氧气获得的电子,32gCu的物质的量为$\frac{32g}{64g/mol}$=0.5mol,故消耗氧气物质的量为$\frac{0.5mol×2}{4}$=0.25mol,则需要氧气体积为0.25mol×22.4L/mol=5.6L,
故答案为:5.6;
(3)依题干信息,将分子中原子排成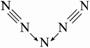 ,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构,“N5”分子碎片所带电荷是一个单位正电荷,电子式为:
,两边的两个氮原子通过形成三对共用电子达到8电子结构,则中间N原子得两边的各一个N原子提供一对电子再失去一个电子,这样此N原子最外层也达8电子结构,“N5”分子碎片所带电荷是一个单位正电荷,电子式为: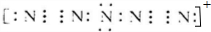 ,
,
故答案为:一个单位正电荷;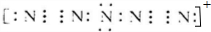 ;
;
(4)2mol氢气燃烧生成气态水放出的热量为:4×463kJ-2×436kJ-496kJ=484kJ,故0.1mol氢气燃烧生成气态水放出的热量为484kJ×$\frac{0.1mol}{1mol}$=48.4kJ,
故答案为:48.4;
(5)已知某元素最高价氧化物对应的水化物的化学式为HaROb,则R原子最高正化合价为+(2b-a),则其最低化合价为-[8-(2b-a)],故它的氢化物为H(8+a-2b) R,
故答案为:H(8+a-2b) R.
点评 本题考查氧化还原反应计算、反应热计算、化学式有关计算、信息给予题等,是对学生综合能力的考查,需要学生具备扎实的基础,属于拼合型题目.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 晶体中的化学键都具有饱和性和方向性 | |
| B. | 晶体中只要有阴离子,就一定有阳离子 | |
| C. | 石墨是一种典型的原子晶体 | |
| D. | 冰中存在极性共价键和氢键两种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
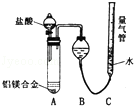 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| B. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气和水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
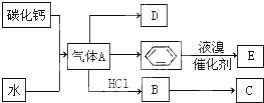
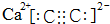 ;D的空间构型为平面结构,键角为120°;
;D的空间构型为平面结构,键角为120°;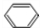 +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$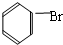 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应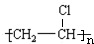 其反应类型为加聚反应
其反应类型为加聚反应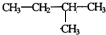 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
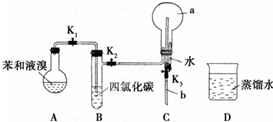
 ,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.
,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水鉴别甲苯、己烷、己烯 | |
| B. | 将稀硫酸、稀硝酸和苯混合加热制硝基苯 | |
| C. | 苯和硝基苯混合物采用分液的方法分离 | |
| D. | 用CuSO4溶液除去由电石和水反应生成的乙炔气体中的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com