
A.KCl B.ZnCl2 C.MgCl2 D.BaCl2
科目:高中化学 来源:设计必修一化学鲁科版 鲁科版 题型:013
|
13.5 g CuCl2样品含下列某一种杂质,此样品与足量硝酸银溶液反应,生成29 g沉淀,则样品中所含杂质为 | |
| [ ] | |
A. |
KCl |
B. |
ZnCl2 |
C. |
MgCl2 |
D. |
BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
本题有I和II两小题。
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是__________(填写编号)。
(2)能够用以精确量取液体体积的是_______(填写编号)。
(3)由于操作错误,使得到的数据比正确数据偏小的是________(填写编号)。
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(4)称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为_________g。
(5)有下列实验:
①苯与溴的取代反应 ②苯的硝化反应
③乙醛的银镜反应 ④测定一定温度下KNO3的溶解度
⑤乙酸乙酯的制取 ⑥石油分馏实验
其中需要使用温度计的有___________(填写编号)
Ⅱ.某种胃药片的制酸剂为碳酸钙,其中所含的CaCO3质量的测定如下:
①需配制0.1 mol/L的HCl和0.1 mol/L的NaOH溶液;
②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20.00 mL蒸馏水;
③以酚酞为指示剂,用0.1 mol/L的NaOH溶液滴定,需用去V mL达滴定终点;
④加入25.00 mL 0.1 mol/L的HCl溶液。
(1)写出实验步骤(写编号顺序)___________________________。
(2)在下图所示的仪器中配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液肯定不需要的仪器是(填序号)________,配制上述溶液还需要的玻璃仪器是(填仪器名称)_________________________。

(3)配制上述溶液应选用的容量瓶规格是_________(填字母)。
A.50 mL 50 mL B.100 mL 100 mL
C.100 mL 150 mL D.250 mL 250 mL
(4)写出有关的化学方程式______________。
(5)每片胃药中含碳酸钙的质量是____________________g。
查看答案和解析>>
科目:高中化学 来源:2015届江苏常州某重点高中高二上学期第二次月考化学试卷(解析版) 题型:实验题
有机物分子式的确定常采用燃烧法,其操作如下:在电炉加热下用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。如图所示是用燃烧法测定有机物分子式常用的装置,其中A管装碱石灰,B管装无水CaCl2。现准确称取1.80 g有机物样品(含C、H元素,还可能含有O元素),经燃烧被吸收后A管质量增加1.76 g,B管质量增加0.36 g。请按要求填空:
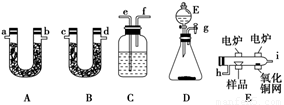
(1)此法适宜于测定固体有机物的分子式,此有机物的组成元素可能是________。
(2)产生的气体按从左到右的流向,所选各装置导管口的连接顺序是________。
(3)E和D中应分别装有何种药品________。
(4)如果将CuO网去掉,A管增加的质量将________(填“增大”“减小”或“不变”)。
(5)该有机物的最简式是________________。
(6)要确定该有机物的分子式,还必须知道的数据是________。
A.消耗液体E的质量 B.样品的摩尔质量
C.CuO固化减少的质量 D.C装置增加的质量
E.燃烧消耗氧气的物质的量
(7)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)取12.5 g黄铜矿样品,经测定含3.60 g硫(杂质不含硫),矿样中CuFeS2含量为 。
(2)已知2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:
2Cu2S+3O2===2Cu2O+2SO2
2Cu2O+Cu2S===6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量。
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜。
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com