
分析 (1)纯水中c(H+)=c(OH-);
(2)求出0.0005mol/L的硫酸溶液中的氢离子浓度,然后根据pH=-lgc(H+)来计算;
(3)在盐酸溶液中,氢离子绝大多数来自酸的电离,而氢氧根全部来自水的电离,故求出pH=3的盐酸溶液中氢氧根的浓度,而水电离出的氢离子浓度和氢氧根浓度相同;
(4)在碱溶液中,氢氧根绝大多数来自碱的电离,而氢离子全部来自水的电离,故求出0.01mol/L的氢氧化钠溶液中氢离子的浓度,而水电离出的氢氧根浓度和氢离子浓度相同;
(5)求出此温度下pH=12的NaOH溶液中氢氧根浓度,然后根据混合后溶液显中性即有:n(H+)=n(OH-)来计算.
解答 解:(1)某温度下,纯水中c(H+)=10-6mol/L,而纯水中c(H+)=c(OH-),故此温度下的Kw=c(H+)•c(OH-)=10-12,故答案为:10-12;
(2)0.0005mol/L的硫酸溶液中的氢离子浓度c(H+)=0.001mol/L,故pH=-lgc(H+)=-lg0.001=3,故答案为:3;
(3)常温下,pH=3的盐酸,c(H+)=0.001mol/L,c(OH-)=10-11mol/L,而在盐酸溶液中,氢离子绝大多数来自酸的电离,而氢氧根全部来自水的电离,故水电离出的c水(OH-)=10-11mol/L,而而水电离出的氢离子浓度和氢氧根浓度相同,故水电离出的c水(H+)=10-11mol/L,故答案为:10-11;
(4)25℃时,在0.01mol/L的NaOH溶液中,c(OH-)=0.01mol/L,c(H+)=10-12mol/L,在碱溶液中,氢氧根绝大多数来自碱的电离,而氢离子全部来自水的电离,故溶液中水电离出的c水(H+)=10-12mol/L,而水电离出的氢氧根浓度和氢离子浓度相同,故水电离出的c水(OH-)=10-12mol/L,故答案为:10-12;
(5)某温度下,KW=1.0×10-13,此温度下pH=2的H2SO4溶液中c(H+)=0.01mol/L,pH=12的NaOH溶液中c(H+)=10-12mol/L,而根据水的离子积为10-13可知,氢氧根浓度c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-12}}$=0.1mol/L,由于混合后溶液显中性,即有:n(H+)=n(OH-),即V1L×0.01mol/L=V2L×0.1mol/L,解得V1:V2=10:1,故答案为:10:1.
点评 本题考查了溶液pH的相关计算,掌握公式的运用是解题关键,应注意到酸溶液和碱溶液中氢离子和氢氧根的来源以及温度对水的离子积数值的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
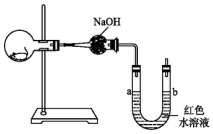 如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )| A. | a端下降,b端上升 | B. | a端上升,b端下降 | C. | a、b两端都下降 | D. | a、b两端都上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>HClO>Cu2+>Fe2+ | B. | Cl2>HClO>Fe3+>Cu2+>Fe2+ | ||
| C. | HClO>Cl2>Fe3+>Cu2+>Fe2+ | D. | HClO>Fe3+>Cl2>Cu2+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 |
| 丙 | 丁 |
| A. | 金属性最强的为丙 | |
| B. | 非金属性最强的为丙 | |
| C. | 如果甲为非金属,则丙一定为非金属 | |
| D. | 如果丁为非金属,则乙可能为金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.9mol | B. | 等于0.45mol | C. | 小于0.45 mol | D. | 大于0.45 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和等体积、等浓度的氨水和氢氧化钠溶液至pH等于7,前者消耗的盐酸多 | |
| B. | 向NaHS 溶液中加入适量 KOH 后:c(Na+)═c(H2S)+c(HS-)+c(S2-) | |
| C. | 将amol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),醋酸的电离常数Ka=$\frac{2×1{0}^{-9}}{a-0.01}$ (用含a的代数式表示) | |
| D. | 向NH4Cl溶液中加入少量等浓度的稀盐酸,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 久置的浓硝酸显黄色 | |
| B. | 铜片放入硝酸中,溶液变蓝 | |
| C. | 碳单质放入浓硝酸中产生大量红棕色的气体 | |
| D. | 浓硝酸敞口放置在空气中,质量会减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com