
| A. | 0.9mol/L | B. | 0.18mol/L | C. | 0.42mol/L | D. | 0.84mol/L |
分析 先根据n=cV分别计算出硫酸中氢离子、氢氧化钠溶液中的氢氧根离子的物质的量,然后计算出混合液中氢离子物质的量,然后根据c=$\frac{n}{V}$计算出混合液中氢离子的物质的量浓度.
解答 解:48mL0.1mol/L硫酸溶液中含有氢离子的物质的量为:n(H+)=×0.048L×0.1mol/L×2=0.0096mol,
4.7mL0.05mol/L氢氧化钠溶液中氢氧根离子的物质的量为:n(OH-)=0.0047L×0.05mol/L=0.000235mol,
显然酸过量,混合液中氢离子浓度为:c(H+)=$\frac{0.0096mol-0.000235mol}{0.048L+0.0047L}$≈0.18mol/L,
故选B.
点评 本题考查了化学方程式的计算,题目难度不大,明确酸碱中和反应实质为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:推断题
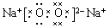
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁原子的电子排布式:[Ar]3d64s2 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 氢氧化钠的电子式: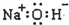 | D. | F的原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O | |
| B. | SO2气体通入Fe2(SO4)3溶液中:SO2+2H2O+2Fe3+=2Fe2++4H++SO42- | |
| C. | 用白醋除铁锈:Fe2O3•xH2O+6H+=(3+x)H2O+2Fe3+ | |
| D. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2互为同位素 | |
| B. | 等质量的${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2所含有的分子数相同 | |
| C. | 标准状况下,1.12L${\;}_{\;}^{16}$O2和1.12L${\;}_{\;}^{18}$O2均含有0.1NA个氧原子 | |
| D. | 通过化学变化可以实现${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2间的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子能够发生布朗运动 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子直径在1-100nm之间 | D. | 胶体粒子不能穿过半透膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com