
分析 达到平衡时c(N2)=3.5 mol•L-1,c(H2)=1 mol•L-1,c(NH3)=5 mol•L-1,则
N2(g)+3H2(g)?2NH3(g)
开始 x y 0
转化 2.5 7.5 5
平衡 3.5 1 5
(1)起始浓度等于转化浓度+平衡浓度;
(2)转化率=$\frac{转化的量}{开始的量}$×100%;
(3)物质的量之比等于压强的之比;
(4)物质的量浓度的分数等于平衡时NH3占总体积的体积分数.
解答 解:达到平衡时c(N2)=3.5 mol•L-1,c(H2)=1 mol•L-1,c(NH3)=5 mol•L-1,则
N2(g)+3H2(g)?2NH3(g)
开始 x y 0
转化 2.5 7.5 5
平衡 3.5 1 5
(1)N2的起始浓度为2.5mol/L+3.5mol/L=6mol/L,H2的起始浓度为7.5mol/L+1mol/L=8.5mol/L,
答:N2和H2的起始浓度分别为6mol/L、8.5mol/L;
(2)N2的转化率为$\frac{2.5}{6}$×100%=41.7%,
答:N2的转化率为41.7%;
(3)平衡时压强为开始时压强的$\frac{3.5+1+5}{6+8.5}$×100%=65.5%,
答:平衡时压强为开始时压强的65.5%;
(4)平衡时NH3占总体积的体积分数为$\frac{5}{3.5+1+5}$×100%=52.6%,
答:平衡时NH3占总体积的体积分数为52.6%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率、体积分数为解答的关键,侧重分析与计算能力的考查,注意三段法的应用,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | B. | 18O2-的结构示意图: | ||
| C. | 羟基的电子式: | D. | 淀粉和纤维素的结构简式:CH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为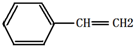 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应,可生成环状的饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<W<Z | |
| B. | Z的氧化物一定只有一种 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C物质的分子数之比为1:3:2 | |
| B. | 容器内气体的密度不再随时间而改变 | |
| C. | 容器内气体的压强不再随时间而改变 | |
| D. | 单位时间内生成a mol物质A,同时生成3a mol物质B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 指示剂 | 酚酞 | 甲基酸 |
| 变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀时pH | 1.1 | 5.9 | 8.4 |
| 沉淀完全时pH | 3.? | 9.? | 10.2 |
| 溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操 作 | 现 象 | 结 论 | |
| A | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和一定量的CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| D | 滴加稀NaOH溶液,并将湿润的红色石蕊试纸置于盛放溶液的试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取9.5mL NaOH溶液 | |
| B. | 用100mL 量筒量取5.20mL 盐酸 | |
| C. | 用托盘天平称取25.20g NaCl固体 | |
| D. | 用100mL量筒配制125mL 0.1mol•L-1盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com