
 ,请写出它与NaOH溶液反应的化学方程式
,请写出它与NaOH溶液反应的化学方程式
 是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到
是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到

 ,起始原料的某烃的结构简式为
,起始原料的某烃的结构简式为 ,为CH3COOCH(CH3)2,属于酯类物质,与NaOH发生水解反应;
,为CH3COOCH(CH3)2,属于酯类物质,与NaOH发生水解反应;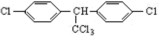 ,由结构对称性可知,苯环上含2种H;
,由结构对称性可知,苯环上含2种H; ,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为
,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为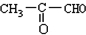 ,D为
,D为 ,E为
,E为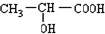 ,可发生缩聚反应生成G
,可发生缩聚反应生成G ,以此解答该题.
,以此解答该题. ,为CH3COOCH(CH3)2,属于酯类物质,与NaOH发生水解反应,该反应为CH3COOCH(CH3)2+NaOH
,为CH3COOCH(CH3)2,属于酯类物质,与NaOH发生水解反应,该反应为CH3COOCH(CH3)2+NaOH| △ |
| △ |
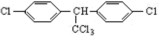 ,由结构对称性可知,苯环上含2种H,共3种H,则核磁共振H谱图中有3个吸收峰,故答案为:3;
,由结构对称性可知,苯环上含2种H,共3种H,则核磁共振H谱图中有3个吸收峰,故答案为:3; ,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为
,A为CH3CHBrCH2Br,B为CH3CHOHCH2OH,C为 ,D为
,D为 ,E为
,E为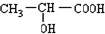 ,可发生缩聚反应生成G
,可发生缩聚反应生成G ,
, ,故答案为:
,故答案为: ;
; ,含羰基和醛基,利用红外光谱仪可测定D中所含官能团,故答案为:羰基和醛基;红外光谱;
,含羰基和醛基,利用红外光谱仪可测定D中所含官能团,故答案为:羰基和醛基;红外光谱;| H2O |
| △ |
| H2O |
| △ |
 ,由逆合成法可知,
,由逆合成法可知, →
→ →
→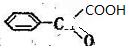 →
→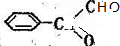 →
→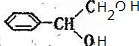 →
→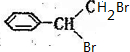 →
→ ,
, ,故答案为:
,故答案为: ;六.
;六.


科目:高中化学 来源: 题型:
| A、100g/mol |
| B、108g/mol |
| C、96g/mol |
| D、55g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)═CO(g)+H2(g) K1 Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2 Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3 |
通入纯氧,主要化学反应: Ⅳ:C(s)+O2(g)═CO2(g) △H=-393.8kJ?mol-1 V:CaCO3(s)═CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol物质燃烧所放出的热量 |
| B、常温下,可燃物燃烧放出的热量 |
| C、在25℃、1.01×105Pa时,1mol纯物质燃烧生成稳定的氧化物时所放出的热量 |
| D、燃烧热随化学方程式前的化学计量数的改变而改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com