
(10��)KNO3����Ҫ�Ļ�����Ʒ��������һ���ѻ��ר����KNO3�Ʊ���������Ҫ���裺
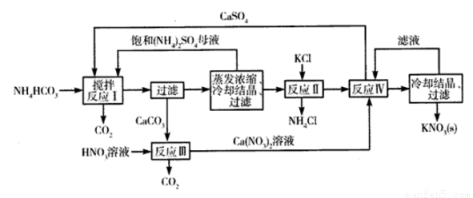
��1����ӦI�У�CaSO4��NH4HCO3�����ʵ���֮��Ϊ1��2���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�����ڸ�̬�����ȵ������½��У����ȵ�Ŀ���� �� �ӷ�Ӧ�����û�����з����CaSO4�ķ����dz��ȹ��ˣ����ȹ��˵�Ŀ���� ��
��3�����鷴Ӧ������K2SO4���Ƿ����KCl�ķ����ǣ�ȡ����K2SO4��Ʒ�ܽ���ˮ�� ��
��4�����������У���ѭ�����õ����ʳ�(NH4)2SO4�⣬���� �� (�ѧʽ)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�����ϵ�һ���¿�����ѧ���ԣ���ѧ�������棩 ���ͣ�ѡ����
��ѧ�뻷�������ϡ���Ϣ����Դ��ϵ���У�����˵����ȷ���ǣ� ��
A����ɫ��ѧ�ĺ�����Ӧ�û�ѧԭ���Ի�����Ⱦ��������
B��������Ч���ܡ�̫���ܵ����͵綯�������Խ�����л�����β���ŷ�����
C��PM2.5��ָ������ֱ���ӽ�2.5��10-6m�Ŀ������ɢ�ڿ������γɽ���
D���뵼����ҵ����һ�仰������ɳ̲���û����������оƬ�IJ����Ƕ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����Ϻ������и���ʵ������ڵ�һ���¿����ۻ�ѧ�������棩 ���ͣ�ѡ����
������( Be)���仯����������ƵĻ�ѧ���ʡ���֪��BeCl2 +Na2BeO2 +2H2O=2NaCl+2Be��OH)2������ȫ���У��������ƶ���ȷ����
A��Be(OH)2�����������ᣬ��������NaOH��Һ
B��BeCI2ˮ��Һ�ĵ�����ǿ����BeCl2�����ӻ�����
C��Na2BeO2��Һ��pH>7���������ɲ����պ�õ��IJ�����ΪBeO
D��BeCl2��Һ��pH>7���������ɲ����պ�õ��IJ����������BeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�����и߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ѡ�� | ʵ����� | ���� | ���� |
A | ��ij��Һ��ϡ���ᷴӦ����������ͨ�����ʯ��ˮ | ʯ��ˮ����� | ����Һ��һ������CO32�� |
B | �����£�����Ƭ��������Ũ������ | ��Ƭ���ܽ� | �����£�����Ũ���� һ��û�з�����ѧ��Ӧ |
C | ��ijʳ����Һ�еμӵ�����Һ | ��Һ��ɫ���� | ����˵����ʳ����һ��û�����ӵ⻯�� |
D | ��ʢ��25mL��ˮ���ձ��еμ�5��6��FeCl3������Һ��������� | ��Һ���ɺ��ɫ���� | �Ƶ�Fe��OH��3���� |
A��A B��B C��C D��D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�����и߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ơ���һ����Ҫ��ѧϰ����������ʱ����������������ƽ�����ȷ���ǣ� ��
A. ��2����Ԫ���⻯����ȶ���˳���ǣ�HF��H2O��NH3�����3����Ԫ���⻯����ȶ���˳��Ҳ�ǣ�HCl��H2S��PH3
B. ��A��Ԫ���⻯��е�˳���ǣ�GeH4��SiH4��CH4�����A��Ԫ���⻯��е�˳��Ҳ�ǣ�AsH3��PH3��NH3
C. �������������ӣ����������ӣ��������������ӣ�����������
D. �ɱ���CO2���Ƿ��Ӿ��壬��SiO2Ҳ�Ƿ��Ӿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ������и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��2Na[Al(OH)4]+CO2=2Al(OH)3��+Na2CO3+H2O����2molNaOH��1molBa(OH)2��2molNa[Al(OH)4]�Ļ����Һ������ͨ��CO2����ͨ��CO2���������ɳ��������Ĺ�ϵ����ȷ����
ѡ�� | A | B | C | D |
n(CO2)(mol) | 2 | 3 | 4 | 6 |
n(����)(mol) | 1 | 2 | 3 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ������и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����м���������ʹ�������ۡ�ʹһ�����Ľ�����һ��ʱ���ڿ�ʼ�����������ʵ�Ũ�ȳ������۳�ֵ��,����ʵġ��۳�ֵ��ԽС����ʾ��������Խ��ʵ��֤������������Ҫȡ���ںͽ������෴��ɵ����������ĵ�����������Խ��������Խ������Fe(OH)3�����м������е����ʱ���䡰�۳�ֵ����С����
A��NaCl B��FeCl3 C��K2SO4 D��Na3PO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����ϳ�ɳһ�и߶��ϵ�һ���¿�����ѧ���ԣ���ѧ���������棩 ���ͣ�ʵ����
�ع顢�Ľ�����չ�̲�ʵ�飬�Ǹ߿���ѧʵ�鿼��ij�����ʽ��
I������ͬѧ�ڽ��С�������ʵ��2-5��Fe3+������H2O2��Һ�ֽ�ʵ���еĴ����á�ʱ������������̽��������Ŀǰѧ����Ԫ�����ڱ������֪ʶ����С���Ʋ���ͬΪ�������ڵ�VIII���Fe��Co��Ni���������ƵĴ�������
���������ϡ����ܼ��仯����㷺Ӧ���ڴ��Բ��ϡ���ز��ϼ���Ӳ���ϵ���������CoxNi(1-x)Fe2O4������Co��Ni��Ϊ+2�ۣ�Ҳ������H2O2�ֽ�Ĵ��������нϸߵĻ��ԡ�
��1��д��H2O2��Һ��Fe3+���·ֽ�Ļ�ѧ����ʽ__________________________________��
��2���ٸô�������Ԫ�صĻ��ϼ�Ϊ ��
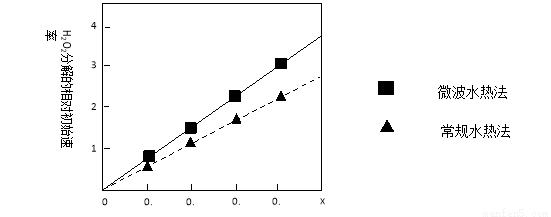
����ͼ��ʾ���ֲ�ͬ�����ƵõĴ���CoxNi(1-x)Fe2O4��10��ʱ���ֽ�6%��H2O2��Һ����Գ�ʼ������x�仯���ߡ���ͼ����Ϣ��֪�� ����ȡ�õ��Ĵ������Ը��ߣ��ɴ��Ʋ�Co2+��Ni2+���������д�Ч�����õ��� ��
II������ͬѧ�ڽ��С�ѡ���ġ�ʵ��2-2��������ҺŨ�ȶ����Ը��������Һ��ɫʱ���Ӱ�족ʱ��������Һ��ɫ����������죬��С����������¹���̽����ԭ��
���������ϡ�KMnO4��Һ����H2C2O4�ķ�Ӧ����Ϊ�������С�III����ΪMn�ļ�̬����
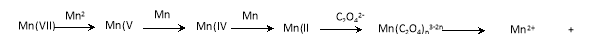
��������衿����1���÷�ӦΪ���ȷ�Ӧ
����2����Ӧ���ɵ�Mn2+ �Ը÷�Ӧ�д�����
����3��K+�Ը÷�Ӧ�д�����
����ơ����ʵ�顿
��3����ȡ g���ᾧ��(H2C2O4��2H2O)������500 mL 0.10 mol/L H2C2O4��Һ�������������б����õ���2�ֶ���������������ƽ��
��4�����̽������¼����
ʵ�� ��� | �ձ��������Լ�������(mL) | �������� | ��Һ��ɫʱ��(s)[K] | |||
0.10 mol/L H2C2O4��Һ | ��Ũ�� KMnO4��Һ | H2O | 0.50 mol/L ϡ���� | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | ˮԡ�����¶�65 �� | 15 |
3 | 30 | 20 | 30 | 20 | ��������MnSO4���� | 3.6 |
4 | 30 | 20 | x | 20 | ����5 mL 0.10 mol/L K2SO4��Һ | 18 |
��ϸ�Ķ������������ݣ��ش����⣺
x = mL������__________�������1�� ����2����3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ˮһ��ѧ�߶�����ĩ��������ѧ������ѧ�������棩 ���ͣ�ʵ����
��1������������Ҫ��ȡNaOH���� g��
��2������ʱ������ʹ�õ����������� ������ţ���
��3������ʱ������ȷ�IJ���˳���ǣ�������ű�ʾ��ÿ������ֻ��һ�Σ� ��
�� ������ˮϴ���ձ�2 ~ 3�Σ�ϴ��Һ��ע������ƿ����
�� ��ʢ��NaOH������ձ��м�������ˮ�ܽ�
�� ���ձ�������ȴ����Һ�ز�����ע������ƿ��
�� ������ƿ�ǽ����������µߵ���ҡ��
�� ���ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
�� ����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1 ~ 2cm��
��4��������������������н�����������ҺŨ��ƫ�ߵ��� �������б�ţ���
������ƿʵ��ǰ������ˮϴ�ɾ�����δ��� �ڶ��ݹ۲�Һ��ʱ����
���ܽ���������ʷ��ȣ�û�е����������� �ܼ�����ˮʱ���������˿̶�
��5������ƿ��������__________(���������)��
�� ����һ�����ȷŨ�ȵı���Һ
�� ������Һ
�� ��������ƿ������µ����������Һ��
�� ȷϡ��ijһŨ�ȵ���Һ
�� ���������ܽ��������
II.����6�֣�ij��ѧС���Ա�����Ϊԭ�ϣ���ȡ�������������֪�й����ʵķе����±���
���� | �״� | ������ | ��������� |
�е�/�� | 64.7 | 249 | 199.6 |
��1��������λͬѧ�ֱ����������ͼ��ʾ������ʵ���Һϳɱ����������װ��(�г������ͼ�������������ȥ)�������л���ķе㣬��ò���______(��ס����ҡ�)װ�á������� ��
��2��ʵ����Ũ�����������________________��
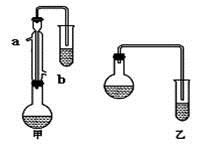
��3����Ӧ��CH3OHӦ������������ ��
��4������������ֲ�Ʒ���������������״����������ˮ�ȣ���������������ͼ���о��ƣ���������ͼ�з�����������������������ơ�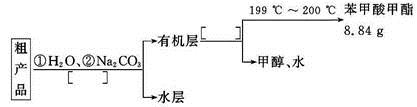
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com