
| A. | v(H2)=0.05mol/(L•min) | B. | v(N2)=0.03mol/(L•min) | ||
| C. | v(NH3)=0.17g/(L•min) | D. | v(NH3)=0.02mol/(L•min) |
分析 该反应中n(NH3)=$\frac{3.4g}{17g/mol}$=0.2mol,该时间段内v(NH3)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02mol/(L•min),同一可逆反应同一时间段内,各物质的反应速率之比等于其计量数之比,据此计算其它物质反应速率.
解答 解:该反应中n(NH3)=$\frac{3.4g}{17g/mol}$=0.2mol,该时间段内v(NH3)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02mol/(L•min),
A.速率之比等于化学计量数之比,则v(H2)=$\frac{3}{2}$v(NH3)=0.03mol/(L•min),故A错误;
B.速率之比等于化学计量数之比,则v(N2)=$\frac{1}{2}$v(NH3)=0.01mol/(L•min),故B错误;
C.反应速率的单位为mol/(L•min),故C错误;
D.由上述计算可知:v(NH3)=0.02mol/(L•min),故D正确;
故选D.
点评 本题考查化学反应速率快慢比较,侧重考查学生分析计算能力,明确化学反应速率与计量数的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
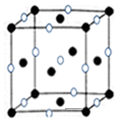 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
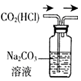 | 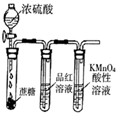 | 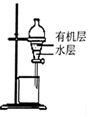 | 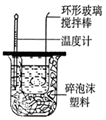 |
| 除去CO2中含有的少量HCl气体 | 说明浓H2SO4具有脱水性,强氧化性,SO2具有漂白性、还原性 | 将有机层从分液漏斗下口放出 | 用于中和反应反应热的测定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 充电时电极b连接电源的正极 | |
| B. | 放电时右侧电解质储罐中的离子总浓度增大 | |
| C. | 放电时电极a连接粗铜可实现粗铜的精炼 | |
| D. | 充电时阴极反应式为2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
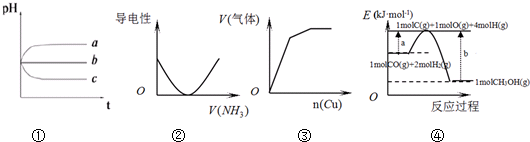
| A. | 图①:pH相同的H2S溶液(a)、稀H2SO4溶液(b)、H2SO3溶液(c)露置于空气中一段时间后,溶液的pH随时间的变化情况 | |
| B. | 图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 | |
| C. | 图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 | |
| D. | 图④:合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=a-b kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①②④ | C. | ②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ③④⑥⑦ | C. | ①②④⑥⑦ | D. | ①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com