
下列解释事实的方程式不正确的是
A.测0.01mol/L的醋酸的pH为5:CH3COOH CH3COO- + H+
CH3COO- + H+
B.电解饱和食盐水,产生气体:2Cl- + 2H2O Cl2↑ +2OH- + H2↑
Cl2↑ +2OH- + H2↑
C.铁放在氧气中燃烧,产生黑色固体:4Fe +3O2 2Fe2O3
2Fe2O3
D.硫酸钙与碳酸钠溶液,产生白色沉淀:CaSO4(S)+CO32- CaCO3(S)+SO42-
CaCO3(S)+SO42-
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
以下有关元素性质的说法不正确的是
A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是①
B.具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③
C.①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③
D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它 与氯气反应时可能生成的阳离子是X3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:实验题
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
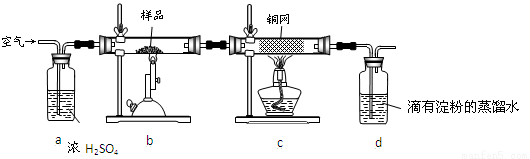
现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
(1)将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是_ ___和__ __(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。
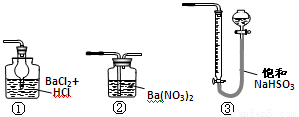
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:填空题
(14分)SO2 、CO 、NOx 是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g) + O2(g)  2SO3(g) △H1 = - 197 kJmol-1
2SO3(g) △H1 = - 197 kJmol-1
H2O(g) = H2O(l) △H2 = - 44 kJmol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3 = - 545 kJmol-1
则SO3(g)与H2O(l)反应的热化学方程式是 。
(2)若反应2H2(g)+ O2 (g)=2H2O(g ),△H=-241.8kJmol-1,根据下表数据则x=______kJmol-1。
化学键 | H-H | O═O | O-H |
断开1mol化学键所需的能量/kJ | 436 | x | 463 |
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H=-90 kJmol-1
CH3OH(g) △H=-90 kJmol-1
①该温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO (g)和2 mol H2(g) | 1 mol CH3OH(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出54kJ | 吸收a kJ |
则c1_________ c2(填“>”或“<”或“=”),a=____________。
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。若Ⅱ反应的n(CO)起始 =10 mol、投料比为0.5,则:
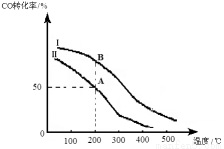
A点的平衡常数KA= ,
B点的平衡常数KB KA。 (填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是 (至少答出两条)。
(4)电解NO制备NH4NO3,其工作原理如图所示,
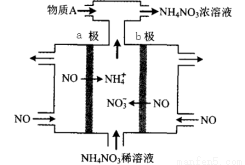
则a电极名称为_______,
b电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:填空题
(14分)工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
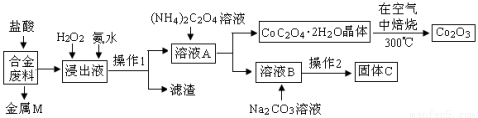
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)由CoC2O4·2H2O转化为Co2O3的化学方程式是 。
(4)知Li2CO3微溶于水,且水溶液呈碱性。其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,在常温条件下,饱和Li2CO3 溶液中离子浓度由大到小的排列顺序为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:选择题
甲、乙、丙三种有机物的结构简式如下图所示,下列说法不正确的是
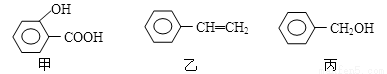
A.甲、乙、丙都能发生加成反应、取代反应
B.丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物
C.淀粉、油脂、有机玻璃等都属于高分子化合物
D.乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省台州市高三3月调研考试理综化学试卷(解析版) 题型:填空题
(10分)以苯为原料合成高分子化合物I的路线如下:
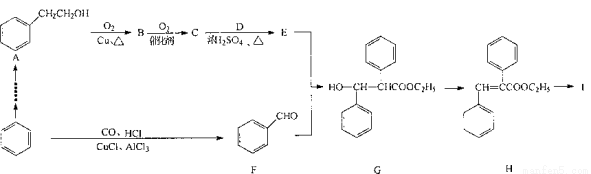
已知有机物的化学性质主要由官能团决定。请回答下列问题:
(1)含有的官能团名称为______;I的结构简式为____。
(2)写出A→B反应的化学方程式:___________;E + F→G的反应类型为____。
(3)写出H与NaOH溶液在加热条件下反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一4月月考理科化学试卷(解析版) 题型:选择题
学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是

A | B | C | D | |
纸蝴蝶上的喷洒液 | 酚酞 | 石蕊 | 酚酞 | 石蕊 |
小烧杯中的溶液 | 浓氨水 | 浓盐酸 | 氢氧化钠溶液 | 浓硫酸 |
A.A B.B C.C D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com