
| A. | 最外层电子构型为ns2(n≠1),次外层电子数为8 | |
| B. | 外围电子构型为3d104s2 | |
| C. | 外围电子排布式为ns2np4 | |
| D. | 外围电子排布式为(n-1)d5ns2 |
分析 利用原子结构中最后填充的电子判断元素的区,最后填充电子为s电子,则属于s区元素,以此来解答.
解答 解:A.最外层电子构型为ns2(n≠1),次外层电子数为8,说明不存在(n-1)d,则最后填充ns电子,为s区元素,故A正确;
B.外围电子构型为3d104s2,最后填充3d电子,为d区元素,故B错误;
C.外围电子排布式为ns2np4,最后填充np电子,为p区元素,故C错误;
D.外围电子排布式为(n-1)d5ns2,最后填充(n-1)d电子,为d区元素,故D错误;
故选:A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握价电子与元素分区的关系为解答的关键,注意利用最后填充的电子判断元素的位置,题目难度不大.


科目:高中化学 来源: 题型:解答题
 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物XZ2中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢元素能形成原子数目之比为1:1的化合物 | |
| C. | Y的单质与稀硫酸、浓硫酸均可发生氧化还原反应 | |
| D. | Z的单质在加热条件下会与Fe反应生成Fe3Z4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.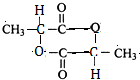 +2H2O;
+2H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;ZX2的化学式是SiO2.
;ZX2的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>W>Z>Y | |
| B. | 化合物ZW3溶于水时水解生成一种弱碱和一种强酸 | |
| C. | X的最高价氧化物能与Z的最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时生成的白烟为离子化合物,且该化合物只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2:3 | B. | 2:1:4:6 | C. | 2:1:4:3 | D. | 1:1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com