
分析 (1)根据化合价的变化趋势判断氧化还原反应的有关概念;
(2)从氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物的角度判断;
(3)根据氧化还原反应得失电子守恒计算.
解答 解:(1)①H2O2+2NaI+H2SO4=I2+Na2SO4+2H2O中,H2O2中O元素化合价降低,H元素化合价不变,则H2O2得电子,被还原,为氧化剂,
③H2O2+2HIO=I2+O2+2H2O中,H2O2中O元素化合价升高,H元素化合价不变,则H2O2失电子,被氧化,为还原剂,
故答案为:A;B;
(2)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物判断:
①H2O2>I2,③HIO>H2O2(该反应中HIO为氧化剂,H2O2为还原剂),则氧化性顺序为HIO>H2O2>I2,
故答案为:HIO>H2O2>I2;
(3)在①反应中,I2为氧化产物,H2O为还原产物,二者的物质的量之比为1:2,当有0.2mol氧化产物生成时,则生成的还原产物是0.4mol,
故答案为:0.4.
点评 本题考查较为综合,涉及物质的分类和氧化还原反应等知识,题目难度不大,注意比较氧化性强弱的角度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 吸收1638 kJ能量 | B. | 放出1638 kJ能量 | C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显血红色,该溶液中一定含有Fe2+ | |
| B. | 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 | |
| C. | 检验Fe(NO3)2是否已氧化变质,可将Fe(NO3)2溶于稀H2SO4后滴加KSCN溶液,再观察溶液是否变血红 | |
| D. | 向某溶液中加NaOH溶液产生红褐色沉淀,说明溶液中含有Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
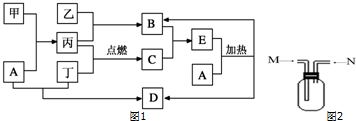
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B具有相同的电子层数 | |
| B. | A的金属活动性顺序排在Zn之后 | |
| C. | A与B能生成A2B3型固态化合物 | |
| D. | A元素的单质与B元素单质反应时,每消耗9 g A的同时消耗16g B |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
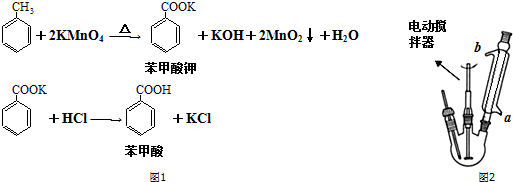
| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com