
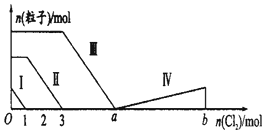
 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )| A. | 线段Ⅲ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=1:3 | ||
| C. | 线段Ⅳ表示IO4-的变化情况 | D. | 根据图象可以计算a的值为6 |
分析 向含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应:2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,又发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据溴离子判断溶液中n(FeBr2),根据离子方程式计算溴离子反应需要的氯气的物质的量,据此计算a的值;
线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该含氧酸中含有I元素,根据电子守恒计算出含氧酸中I的化合价,然后写出其化学式.
解答 解:向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,
A.根据分析可知,线段Ⅲ表示Br-的变化情况,故A正确;
B.n(FeI2):n(FeBr2)=n(I-):n(Br-)=2mol:6mol=1:3,故B正确;
C.线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该元素为I元素,已知碘单质的物质的量为2mol,反应消耗氯气的物质的量为5mol,根据电子守恒,则该含氧酸中碘元素的化合价为:$\frac{(1-0)×2×5mol}{2mol}$=+5价,则该含氧酸为HIO3,即:线段Ⅳ表示IO3-的变化情况,故C错误;
D.由分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要氯气的物质的量为3mol,故a=3+3=6,故D正确;
故选C.
点评 本题考查氧化还原反应计算、氧化还原反应先后顺序、氧化性和还原性强弱比较等知识,试题综合性较强,难度较大,明确反应过程及反应原理为解题关键,试题培养了学生的分析能力及逻辑推理能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
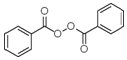 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程: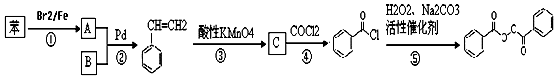
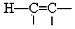 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$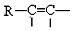
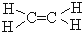 ;
;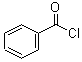 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$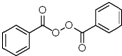 +2HCl;
+2HCl;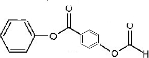 、
、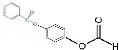 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
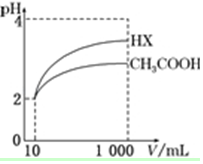 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3NA | |
| B. | 1L 0.5 mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目小于0.5NA | |
| C. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| D. | 1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度为3 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. | 两个反应都只发生了共价键的断裂和形成 | |
| C. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1023 | |
| D. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509 kJ/mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑦ | B. | ①②③④⑤⑦ | C. | ①②③④⑥ | D. | ①④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取、分液前需对分液漏斗检漏 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出 | |
| C. | 为保证分液漏斗内的液体顺利流出,需将分液漏斗上面的塞子打开 | |
| D. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com