
| A. | 石墨 | B. | 烧碱溶液 | C. | 铜 | D. | 氯化钠晶体 |
科目:高中化学 来源: 题型:选择题
| A. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯水除去FeCl2溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
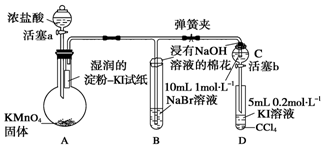
 ;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.
;A中发生的反应的化学反应方程式为2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④ | C. | ②③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com