
| A.将乙酸和乙醇混合加热制乙酸乙酯 |
| B.用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 |
| C.CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D.苯和浓溴水反应制溴苯 |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:不详 题型:实验题
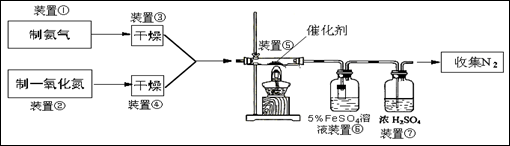
| A.氯化钙 | B.浓硫酸 | C.五氧化二磷 | D.碱石灰 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制取溴苯:将铁屑、溴水、苯混合加热 |
| B.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 |
| C.鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 |
| D.检验卤代烃中的卤原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀的颜色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
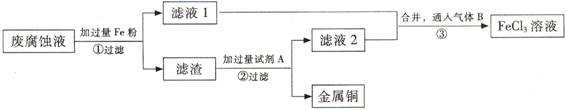 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
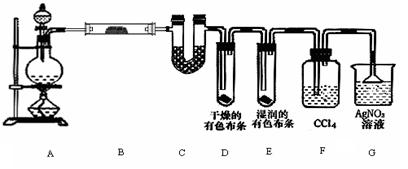
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
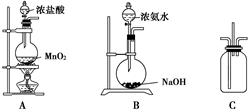
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com