
ij��ѧ��ѧ��ȤС��Ϊ�˲ⶨij��ɽʯ��ʯ��̼��Ƶ�����������ȡʯ��ʯ��Ʒ��������10%��ϡ�������ձ��з�Ӧ(����ʯ��ʯ��Ʒ�����ʲ���ϡ���ᷴӦҲ������ˮ)���й�ʵ���������±���
��Ӧǰ | ��Ӧ�� | ||
ʵ�� ���� | �ձ���ϡ��������� | ʯ��ʯ��Ʒ������ | �ձ������л��������� |
134.4 g | 10 g | 141.1 g | |
����㣨д��������̣���
��1����ʯ��ʯ��̼��Ƶ�����������
��2���μӷ�Ӧ10%�������������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ����
A����KAl(SO4)2��Һ�еμ�Ba(OH)2��Һ��Al3+ǡ�ó�����ȫ��2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3��+3BaSO4��
B����NH4HSO4��Һ�еμӹ���NaOH��Һ�����ȣ�NH4++OH�� H2O+NH3��
H2O+NH3��
C����AlCl3��Һ�еμӹ�����ˮ��Al3++4NH3?H2O=[Al(OH)4]-+4NH4+
D��FeO����ϡ�����У�FeO+2H+=Fe2++H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������и�����ѧ�����в������ۻ�ѧ�Ծ��������棩 ���ͣ������
��8��12������Σ���ֿⱬը������������Ʋ����ش���ʧ���ݲ�Σ���ֿ��д��д������ơ��ء����ף�P4��������狀��軯�ƣ�NaCN������ش��������⣺
��1���ơ����Ż����п����������� ��
A. ˮ B.�ɱ� C.ϸɳ D.��ĭ�����
��2�������ж��ܺ�������Һ����������ԭ��Ӧ��3P4 + 10HClO3 + 18H2O = 10HCl + 12H3PO4���÷�Ӧ����������_________������������_________������1 mol P4�μӷ�Ӧת�Ƶ���Ϊ_________mol��
��3��NH4NO3Ϊ��ը��ڲ�ͬ�¶��¼��ȷֽ⣬���ܷ�����������ԭ��Ӧ��Ҳ���ܷ���������ԭ��Ӧ�����з�Ӧһ�������ܷ������� ��
A. NH4NO3 �� N2 + O2 + H2O B. NH4NO3 �� NH3 + HNO3
C. NH4NO3 �� O2 + HNO3 + H2O D. NH4NO3 �� N2 + HNO3 + H2O
��4��NaCN���ھ綾���ʣ��ж�����������������
��H2O2��������NaCN + H2O2 �� N2��+ X + H2O���Ʋ�X�Ļ�ѧʽΪ ��
����TiO2Ϊ������NaClO��CN��������ΪCNO����CNO�������������¼�����NaClO��Ӧ����N2��CO2��Cl2�ȡ�ȡŨ����CN���ķ�ˮ�����NaClO��Һ�Ļ��Һ��200mL��������CN����Ũ��Ϊ0��2 mol��L��1������ʵ�顣д��CNO-�����������±�NaClO���������ӷ���ʽ__________________����������CO2������Ϊ1.408g�����ʵ���в��CN���������İٷ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ�°���У��������ѧ�ڵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
������ɫ�����У�����һ��������������ɫԭ����ͬ����
A������������ʹ���Ը��������Һ��ɫ
B����ˮ��ʹ������ɫ
C��Ũ������ʹʯ����Һ��ɫ
D��������ʹƷ����Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���ѧ�����б���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���Cl2���ʵ�˵����ȷ����
A���ܶȱȿ���С B������ɫ��ζ������
C����ʹ�������ɫ������ɫ D������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ��һ��ѧ�ڰ��ڿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ����ʽ��д��ȷ����
A��Fe2O3+2H2SO4�T2FeSO4+2H2O
B��2NaOH+K2CO3�T2KOH+Na2CO3
C��2H2O2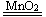 2H2��+O2��
2H2��+O2��
D��Fe+2AgNO3�TFe��NO3��2+2Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ��Զ�и߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ı�����һ��������ͨ�������ӵİٷ�������߷�Ӧ���ʵ���
A������ B����ѹ C������ D������Ӧ��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�pH=1��ij��ҺA�л�����NH4+��K+��Na+��Fe3+��Al3+��Fe2+��CO32-��NO3-��Cl-��I-��SO42���е�4�֣��Ҹ����ӵ����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L����ȡ����Һ�����й�ʵ�飬ʵ��������ͼ��ʾ��
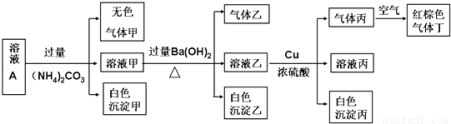
�����й�˵����ȷ����
A��������һ����BaCO3��������BaSO4
B��ʵ������Cu 14.4 g�������������Ϊ3.36L
C������ҺA��һ����NO3-��Al3+��SO42����Cl-
D�����ɵļס��ҡ��������Ϊ��ɫ��������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�������ȷ����

A���ò�����պȡCH3COOH��Һ����ˮʪ���pH��ֽ�ϣ��ⶨ����Һ��pH
B���к͵ζ�ʱ���ζ�������ʢװ�ķ�ӦҺ��ϴ2��3��
C����װ�ü�Һ���ų�ˮ����ٴӷ�Һ©���¿ڷų��л���
D����װ���Ҽ��ȷֽ�NaHCO3����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com