
| A. | 15 | B. | 16 | C. | 19 | D. | 20 |
分析 分子式为C8H11N的芳香族化合物,分子上含有1个苯环,若苯环上有1个侧链,可以是-NHCH2CH3或-CH2NHCH3或N(CH3)2或-CH(NH2)或CH2CH2NH2;苯环上有2个侧链,可以是-CH2CH3、-NH2或-CH3、-CH2NH2或-CH3、-NHCH3,两个取代基分为邻、间、对3种结构;苯环上有3个侧链,只能是-CH3、CH3、-NH2,两个取代基分为邻、间、对3种结构,再根据苯环上氢原子的种类,确定连接氨基后的同分异构体数目;
解答 解:若苯环上有1个侧链,可以是-NHCH2CH3或-CH2NHCH3或N(CH3)2或-CH(NH2)或CH2CH2NH2,共有5种结构;
苯环上有2个侧链,可以是-CH2CH3、-NH2或-CH3、-CH2NH2或-CH3、-NHCH3,两个取代基分为邻、间、对3种结构,共有9种结构;
苯环上有3个侧链,只能是-CH3、CH3、-NH2,两个取代基分为邻、间、对3种结构,
邻二甲苯苯环上氢原子有2种,若连接一个氨基,应为2种异构体.
间二甲苯苯环上氢原子有3种,若连接一个氨基,应为3种异构体.
对二甲苯苯环上氢原子有1种,若连接一个氨基,应为1种异构体.
则所有芳香族化合物的同分异构体共有共5+9+2+3+1=20,故选D.
点评 本题主要考查了同分异构体数目的判断,确定支链的结构是解决问题的关键,难度较大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:填空题
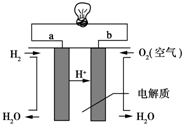 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| B. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32-通电 | |
| C. | 工业上用电解法制备烧碱:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | NaHCO3溶液中HCO3-水解方程式:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将氨通入盐酸中:NH3+H+=NH4+ | |
| B. | 在稀NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-=NH3↑+H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀:AgCl(S)+I-?AgI(S)+Cl- | |
| C. | 吸滤瓶中的溶液应从吸滤瓶的支管口处倒出 | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2 ?2XY2 | B. | 2X2+Y2 ?2X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
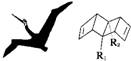 始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与CH2═CH-CH═CH2互为同系物 | |
| B. | 若R1、R2为-CH3,则其化学式为C12H16 | |
| C. | 若R1═R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种 | |
| D. | 始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com