
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。
【答案】B
【解析】
A. 因为MgCO3是微溶物,其溶度积远远大于Mg(OH)2,所以除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,A项正确;
B. 因为Ca(OH)2是微溶物,其溶度积远大于CaCO3,所以除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,B项错误;
C. 向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
![]() ,
,![]() ,所以
,所以![]() ,C项正确;
,C项正确;
D. 将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和,c(Ca2+)=1.054×10-2mol/L,c(OH-)=2.108×10-2mol/L,若保持温度不变,向其中加入100mL 0.012mol/L的NaOH,混合后,c(Ca2+)=0.527×10-2mol/L,![]() ,此时Ca(OH)2的离子积
,此时Ca(OH)2的离子积![]() ,则该溶液变为不饱和溶液,D项正确;
,则该溶液变为不饱和溶液,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式________________________。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为_______个、_______个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为______________、_______(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。
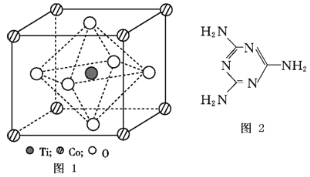
三聚氰胺分子中氮原子轨道杂化类型是______,1 mol三聚氰胺分子中σ键的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 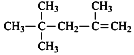 的一氯代物有4种
的一氯代物有4种
B. 异丙苯苯环上的二氯代物有6种
C. ![]() 的同分异构体属芳香烃且含相同官能团的有3种
的同分异构体属芳香烃且含相同官能团的有3种
D. 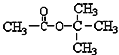 在核磁共振氢谱中能出现两个峰,且其峰面积之比为1:3
在核磁共振氢谱中能出现两个峰,且其峰面积之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:C6H5-CH3+2KMnO4![]() C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
(制备产品)30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在80℃下反应30min,装置如图所示:
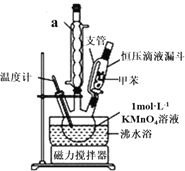
(1)仪器a的名称是___,图中支管的作用是______;
(2)相对于用酒精灯直接加热,用沸水浴加热的优点是_____,在本实验中,三颈烧瓶最合适的容积是___(填字母);
A.50mL B.100mL C.200mL D.250mL
(分离产品)他们设计如下流程分离粗产品苯甲酸和回收甲苯:

(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_____;
(4)操作Ⅲ的名称是_____,固体B中可能会有________杂质离子,检验该离子的方法是_________;提纯B所用的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据物质的量的相关公式,完成下列问题。(注意书写单位)
(1)3.01×1023个NH3分子的物质的量__。
(2)0.5molH2SO4含有的氧原子的物质的量__。
(3)2.3gNO2的物质的量__。
(4)标况下,33.6LN2的物质的量___。
(5)0.5mol /LK2SO4溶液中,c(K+)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
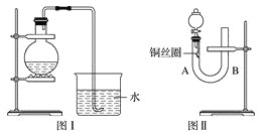
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
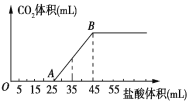
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,下列说法不正确的是
MnCl2+Cl2↑+2H2O,下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1mol Cl2,转移电子的物质的量为2mol
C. 每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D. 转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确移取20.00mL某待测 NaOH溶液于锥形瓶中,用0.1000mol·L-1盐酸滴定。用酚酞作指示剂,下列说法不正确的是:
A. 常温下,0.1000mol·L-1盐酸pH=1
B. 酸式滴定管用蒸馏水洗涤后,再用盐酸润洗
C. 随着盐酸的滴入,锥形瓶中溶液pH逐渐变小
D. 当滴入最后一滴盐酸时,溶液由无色变为浅红色,且30s内不褪色,即为滴定终点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com