
短周期元素的X、Y、Z、W原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多2,W与X同主族,则( )
A.原子半径:Y<Z<W
B.单质的还原性:Y<Z
C.气态氢化物的稳定性:X>W
D.Y和Z两者最高价氧化物对应的水化物不能相互反应
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) 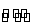 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
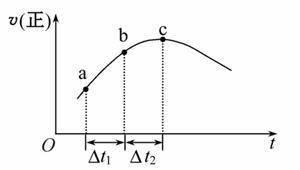
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,消耗的SO2:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:_____________________________________________。
(2)[2013·广东理综,32(3)]完成煅烧过程中一个反应的化学方程式:________CuO+________Al2O3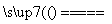 ________CuAlO2+________↑。
________CuAlO2+________↑。
查看答案和解析>>
科目:高中化学 来源: 题型:
M和N两溶液分别含有下列十二种离子中的五种和七种离子:K+、Na+、H+、NH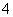 、Fe3+、Al3+、Cl-、OH-、NO
、Fe3+、Al3+、Cl-、OH-、NO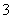 、S2-、CO
、S2-、CO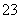 、SO
、SO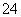 。已知两溶液所含离子各不相同,N溶液里的阳离子只有两种,则N溶液里的阴离子一定有 ( )
。已知两溶液所含离子各不相同,N溶液里的阳离子只有两种,则N溶液里的阴离子一定有 ( )
A.OH-、CO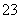 、S2- B.S2-、Cl-、SO
、S2- B.S2-、Cl-、SO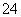
C.CO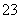 、NO
、NO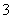 、S2- D.Cl-、SO
、S2- D.Cl-、SO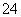 、NO
、NO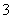
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+ 、K+、MnO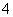 、CO
、CO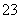
B.c(H+ )=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO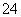 、NO
、NO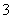
C.0.1 mol·L-1 NH4HCO3溶液中:K+ 、Na+ 、NO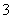 、Cl-
、Cl-
D.0.1 mol·L-1 FeCl3溶液中:Fe2+ 、NH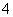 、SCN-、SO
、SCN-、SO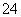
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )。
A.溴水中有Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.反应CO(g)+NO2(g)  CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com