
| A. | 将水加热,平衡向正向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,水电离的c(OH-)增大 | |
| C. | 向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大 | |
| D. | 向水中加入少量NaHSO4固体,水的电离平衡向逆向移动,c(H+)增大 |
分析 A.水的电离是吸热反应,升高温度促进水电离,离子积常数只与温度有关;
B.酸或碱抑制水电离;
C.含有弱离子的盐促进水电离,离子积常数只与温度有关;
D.酸或碱抑制水电离.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,离子积常数只与温度有关,所以升高温度水的电离平衡正向移动,水的离子积常数增大,故A错误;
B.酸或碱抑制水电离,NaOH是强碱,所以抑制水电离,则水电离的c(OH-)减小,故B错误;
C.含有弱离子的盐促进水电离,离子积常数只与温度有关,醋酸钠是强碱弱酸盐,促进水电离,但温度不变,水的离子积常数不变,故C错误;
D.硫酸氢钠完全电离生成氢离子,导致其溶液相当于强酸溶液,抑制水电离,溶液中c(H+)增大,故D正确;
故选D.
点评 本题以电解质的电离及盐类水解为载体考查水的电离,为高频考点,注意:离子积常数只与温度有关,与溶液酸碱性及浓度无关,易错选项是D.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用下图装置制取少量溴苯,试填写下列空白.
实验室用下图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4的电子式: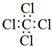 | B. | 乙烯的球棍模型 | ||
| C. | 乙酸的最简式:CH2O | D. | 丙烯醛的结构简式:CH2CHCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com