
| A. | 检验试液中的SO42-:试液$\stackrel{足量稀硝酸}{→}$无沉淀$\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液}{→}$$\stackrel{振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr3: |
分析 A.溶液中硫酸根离子的检验用的是盐酸酸化的氯化钡溶液;
B.饱和碳酸钠能吸收乙醇,能和乙酸反应生成可溶性的乙酸钠,能降低乙酸乙酯的溶解度,乙酸乙酯不易溶于水且位于水的上层;
C.硝酸具有强氧化性,可氧化碘离子;
D.硝酸具有强氧化性,能氧化亚铁离子生成铁离子.
解答 解:A.溶液中硫酸根离子的检验用的是盐酸酸化的氯化钡溶液,硝酸具有强氧化性,能氧化亚硫酸根离子生成硫酸根离子而干扰实验,故A错误;
B.饱和碳酸钠能吸收乙醇,能和乙酸反应生成可溶性的乙酸钠,能降低乙酸乙酯的溶解度,乙酸乙酯不易溶于水且位于水的上层,然后再用分液方法分离提纯,故B正确;
C.硝酸具有强氧化性,可氧化碘离子生成碘,从而干扰双氧水氧化性的检验,故C错误;
D.硝酸具有强氧化性,能氧化亚铁离子生成铁离子,从而干扰铁离子的检验,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、物质分离和提纯,明确实验原理、物质性质是解本题关键,注意:离子检验时要排除其它离子或物质的干扰,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,1 mol•L-1醋酸溶液与0.5 mol•L-1醋酸溶液中,c(H+)之比是2:1 | |
| B. | 向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c(CH3COO-) | |
| C. | 保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| D. | 0.1 mol•L-1NH4Cl溶液中c(NH4+)+c(H+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
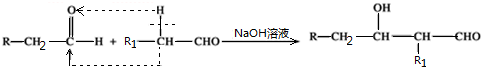
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 12g的金刚石晶体中含有碳碳键的数目为4NA | |
| B. | 4g氦气含有的原子总数为NA | |
| C. | 石墨中C和C-C键的比为2:3 | |
| D. | 60gSiO2含有Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com