
| A.溶液中导电粒子的数目减少 |
| B.溶液中C(CH3COO-)/C(CH3COOH).c(OH-)不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH = 11的NaOH溶液,混合液pH=7 |
 知
知 ,所以
,所以 =
= 其中
其中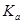 表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,溶液显酸性,D不正确,答案选B。
表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,溶液显酸性,D不正确,答案选B。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 CH3COO- + H+,下列叙述正确的是
CH3COO- + H+,下列叙述正确的是| A.加入水时,平衡左移 | B.加入少量0.1mol/LHCl溶液,溶液中c(H+)减小 |
| C.加入少量NaOH固体,平衡右移 | D.加入少量CH3COONa固体,平衡右移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Ki1的表达式为 |
B.Ki2对应的电离过程是HCO3— + H2O  H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0. 1 mol?L-1 HA中c(H+)= c(OH-)+ c(A-) |
| B.0. 1 mol?L-1 HA与 0. 1 mol?L-1NaOH 混合至溶液呈中性:c(Na+)= c(A-) |
| C.0. 1 mol?L-1 NaA 中c(Na+)> c(OH-)>c(A-)> c(H+) |
| D.0. 1 mol?L-1 HA中加入少量NaA固体,HA的电离常数减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a、b、c三点溶液的pH:c<a<b |
| B.a、b、c三点醋酸的电离程度:c<a<b |
| C.若用湿润的pH试纸测量a处溶液的pH,测量结果偏小 |
| D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2CO3
H2CO3 CO2+H2O
CO2+H2O HPO42-
HPO42-  H2PO4-
H2PO4-| A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定 |
| B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定 |
| C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒 |
| D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 >HSO3->
>HSO3-> ,水杨酸(
,水杨酸( )与亚硫酸钠溶液反应,可能生成的物质是
)与亚硫酸钠溶液反应,可能生成的物质是A. | B.SO2 | C.NaHSO3 | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2H+ + B2-
2H+ + B2-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com