
 ;④氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为:
;④氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ;⑨Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
;⑨Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;
; ;
; ;
; ;
;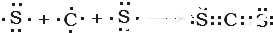 ,⑩氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为
,⑩氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为
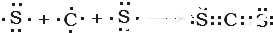 ;
; .
.


科目:高中化学 来源: 题型:
| A、只有① | B、只有②③ |
| C、只有①③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅③正确 | B、仅④不正确 |
| C、③④不正确 | D、全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出).已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素.
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出).已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com