
| A. | 铷与水反应的现象跟钠相似 | |
| B. | 硝酸铷易溶于水 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
分析 同主族元素的性质具有相似性和递变性,碱金属元素从上到下,金属性依次增强,熔沸点依次降低,据此解答.
解答 解:A.铷排在钠的下方,活泼性强于钠,与水反应剧烈程度远远大于钠与与水,故A错误;
B.依据硝酸盐、硝酸钠、硝酸钾的易溶于水的性质推知硝酸铷易溶于水,故B正确;
C.碱金属元素从上到下,熔沸点依次降低,所以在钠、钾、铷三种单质中,铷的熔点最低,故C错误;
D.碱金属元素从上到下,金属性依次增强,元素最高价氧化物对应水化物碱性增强,所以氢氧化铷是强碱,故D错误;
故选:B.
点评 本题考查了元素周期律知识,熟悉同主族元素的性质具有相似性和递变性是解题关键,注意知识的迁移应用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式C2H4 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式 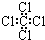 | D. | 环己烷的键线式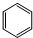 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl-不能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
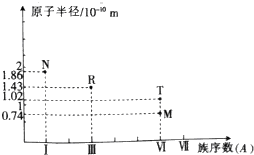
| A. | 常压下,单质R的熔点高于单质M的熔点 | |
| B. | R、T的简单离子都会破坏水的电离平衡 | |
| C. | N2M2与R2M3中所含化学键的类型完全相同 | |
| D. | N、R、T的最高价氧化物对应的水化物之间能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色逐渐变浅 | |
| B. | 气态氢化物的稳定性逐渐增强 | |
| C. | 从F→I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 单质的熔沸点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
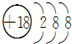 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com