
| A. | 13 | B. | 4个 | C. | 6个 | D. | 7个 |
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题

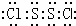 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.
碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中滴加浓氨水:c(Cl-)=c(NH4+)+c(NH3•H2O) | |
| B. | 向NH4HSO4溶液中加入NaOH固体:c(Na+)>c(SO42-)>c(NH4+) | |
| C. | 向CH3COONa溶液中通入HCl气体:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 向KOH溶液中通入SO2气体:c(K+)=2c(SO32-)+c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
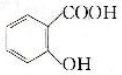 .
.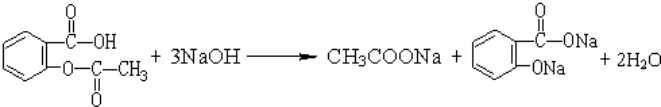 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①②中的SO2气体和CO2气体可以用澄清石灰水溶液鉴别 | |
| B. | 步骤③中,检验FeCl3(aq)溶液中是否存有Fe2+,应该选用KSCN溶液 | |
| C. | 三个步骤中都没有氧化还原反应 | |
| D. | 常温下,H2SO3溶液中通入少量氯气,溶液pH减小,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2是直线型分子,推测CS2也是直线型分子 | |
| B. | SiH4的沸点高于CH4,推测H2Se的沸点高于H2S | |
| C. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com