
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
A. M B. M2+ C.M3+ D. MO2+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
工业上可利用甲烷除去NO气体,反应为CH4(g)+4NO(g)  CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
CO2(g)+2N2(g)+2H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.单位时间内消耗CH4和N2的物质的量比为1∶2时,反应达到平衡
C.平衡时,其他条件不变,增加CH4的浓度,氮氧化物的转化率减小
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.只含有一种元素的物质一定是纯净物
B.石墨转变为金刚石为化学变化
C.水很稳定是因为水分子间存在较强的分子间作用力
D.相对分子质量相同的不同物质一定是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是________________________________________________;
②反应最剧烈的烧杯是_______(填字母);
③写出b烧杯里发生反应的离子方程式______ _____ __。
(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了右图装置以验证碳、氮、硅元素的非金属性强弱。
乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。

①写出所选用物质的化学式:A、________; B、________;C、________。
②写出烧瓶中发生反应的化学方程式:
___________________________________________________________。
③写出烧杯中发生反应的化学方程式:
___________________________________________________________。
④碳、氮、硅元素的非金属性强弱顺序为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
R、X、Y、和Z是四种元素,其常见化合价均为+2,且X2+与单质R不反应;X2++Z=X+Z2+,Y+Z2+=Y2++Z,这四种离子被还原成0价时表现的氧化性大小顺序为( )
A.R2+﹥X2+﹥Z2+﹥Y2+ B. X2+﹥R2+﹥Y2+﹥Z2+
C. Y2+﹥Z2+﹥R2+﹥X2+ D. Z2+﹥X2+﹥R2+﹥Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl‑)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
用9mol/L的浓硫酸稀释成 0.9mol/L的稀硫酸 100mL ,回答下列问题:
(1)配制操作可分解成如下几步,以下正确的操作顺序是_____________________
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(2)如果实验室用98%的浓硫酸(密度为1.8g·cm-3 ) 配制3. 6 mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为_____________mL。
(3)由于错误操作, 使得到的浓度数据比正确的偏大的是___________(填写序号)。
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用
查看答案和解析>>
科目:高中化学 来源: 题型:
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为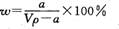
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于O.5w
C.溶液中
D.溶质的物质的量浓度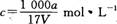
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的表达式正确的是

 A.乙烯分子的比例模型示意图: B.乙醇的结构简式:CH3CH2OH
A.乙烯分子的比例模型示意图: B.乙醇的结构简式:CH3CH2OH
C.2-甲基-2-丁烯的键线式 D.1,3-丁二烯的分子式:C4H8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com