
| A. | ${\;}_{6}^{14}C$、${\;}_{7}^{14}N$互为同位素 | |
| B. | NH3的电子式: | |
| C. | 质量数为133、中子数为78的铯原子:${\;}_{78}^{133}Cs$ | |
| D. | ${\;}_{8}^{18}{O}^{2-}$的结构示意图: |
分析 A.同种元素的不同原子互为同位素,必须是同一种因素;
B.氨气为共价化合物,分子中含有3个N-H键;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.氧离子的核电荷数为8,不是10.
解答 解:A.两种元素为C、N元素,属于不同元素的原子,一定不属于同位素,故A错误;
B.氨气属于共价化合物,NH3的电子式为 ,故B正确;
,故B正确;
C.质量数为133、中子数为78的铯原子的质子数为:133-78=55,该核素的正确表示方法为:55133Cs,故C错误;
D.氧离子的核电荷数为8,核外电子总数为10,氧离子正确的离子结构示意图为: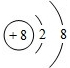 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及离子结构示意图、元素符号、电子式、同位素等知识,明确化学用语的概念及书写原则为解答关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含等物质的量的FeBr2和FeI2溶液中缓慢的通入氯气:I-、Br-、Fe2+ | |
| B. | 在含等物质的量的Fe3+、Cu2+、Fe2+溶液中只加入Zn:Fe3+、Cu2+、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2和KOH溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3 | |
| D. | 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴滴加盐酸:AlO2-、Al(OH)3、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
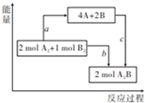 已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )
已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )| A. | a=1370kJ | |
| B. | 该反应是吸热反应 | |
| C. | A、B原子更易结合生成A2B | |
| D. | 反应的能量转化形式,由化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Pb(NO3)2 | B. | 有Pb(NO3)4 | C. | 有PbO | D. | 有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用到金属钠时,要用镊子取、再用小刀切下所需量,剩余的钠不能放回原试剂瓶中 | |
| B. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| C. | 比较不同浓度硫酸与Na2S2O3反应的速率不能通过观察气泡逸出快慢比较,因为SO2易溶于水 | |
| D. | 通过测定等物质的量浓度的NaCl、Na2S溶液的pH,比较硫、氯两种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com