
| A. | SiC>C(金刚石)>Si | B. | Al>Mg>Na | C. | H2O>H2Se>H2S | D. | KCl>NaCl>LiCl |
分析 A、原子晶体,键长越短,键能越大,物质的熔点越高;
B、金属离子的半径越小,电荷越多,金属键越强,则熔点越高;
C、分子晶体含有氢键的物质熔点异常的高;
D、离子晶体中熔沸点与晶格能成正比,晶格能与离子电荷成正比、与离子半径成反比,据此分析解答.
解答 解:A、键长顺序:C-C<Si-O<Si-C,所以,熔沸点大小顺序是:金刚石>石英>SiC,故A错误;
B、金属离子的半径越小,电荷越多,金属键越强,则熔点越高,应为Na<Mg<Al,故B正确;
C、分子晶体含有氢键的物质熔点异常的高,水分子间存在氢键,所以熔点越高,H2O>H2Se>H2S,故C正确;
D、离子晶体中熔沸点与晶格能成正比,晶格能与离子电荷成正比、与离子半径成反比,所以LiCl>NaCl>KCl,故D错误;
故选BC.
点评 本题考查晶体熔点的比较,明确不同类型晶体熔点的比较方法是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇与氧气反应生成醛 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 乙醇与浓硫酸加热到140℃ | |
| D. | 乙酸乙酯与稀硫酸共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
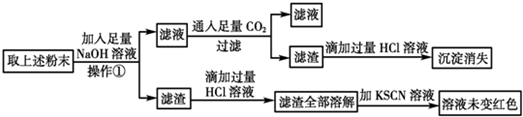
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 7.2g | C. | 8.0g | D. | 16.Og |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | NH3、PH3、AsH3的稳定性和沸点随 N、P、As 的核电荷数的变化趋势如图所示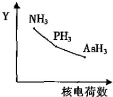 | |
| D. | CS2、H2O、C2H2都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中含有的共价键数为0.2NA | |
| B. | 7.8gNa2S与Na2O2的混合物中含离子总数为0.3NA | |
| C. | 7.8gNa2O2与足量的CO2充分反应,产生O2的分子总数为0.1NA | |
| D. | 0.2molNa被完全氧化生成7.8gNa2O2,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
某温度下,将2molA和3molB充入一密闭的容器中发生反应:aA(g)+B(g)  C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
A.a=3 B.a=2 C.B的转化率为40% D.B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
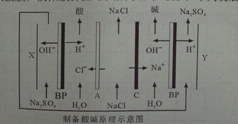
| A. | A为阳离子交换膜,C为阴离子交换膜 | |
| B. | X为阴极,发生的电极反应方程式为:4OH--4e-=O2↑+2H2O | |
| C. | 在X、Y极室加入Na2SO4,目的是提供制备的酸和碱的阳离子或阴离子 | |
| D. | 通过该装置,不但海水得到了淡化,同时还可以得到NaOH、HCl、H2、O2等物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com