
分析 某无色透明的混合气体中可能含有N2、O2、Cl2、HCl、NH3、NO、NO2中的两种或多种气体,无色气体可以确定无黄绿色的Cl2、红棕色的NO2;混合气体通过浓H2SO4后,体积缩小,则一定有NH3,从而确定没有HCl气体;把剩余气体排入空气中变红棕色,说明一定有NO,则一定没有O2,据此进行解答.
解答 解:混合气体为无色透明,说明一定不含有色气体Cl2、NO2;
将混合气体通入浓硫酸后体积减小,说明一定含有NH3,由于氨气与硫化氢反应,从而推断一定没有HCl;
剩余气体通入空气变成红棕色,证明一定含有一NO,由于NO与氧气反应,则混合气体中一定没有O2;
所以原混合气体中一定含有NH3和NO,一定没有HCl、NO2、O2、Cl2,无法确定是否含有N2,
故答案为:NH3、NO;HCl、NO2、O2、Cl2;N2.
点评 本题考查常见气体的检验,题目难度不大,注意掌握常见气体的性质以及检验方法,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 泡沫铝是纯净物 | |
| B. | 泡沫铝是一种合金 | |
| C. | 泡沫铝是一种优质的建筑材料和轻质材料 | |
| D. | 泡沫铝可用于飞机制造 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
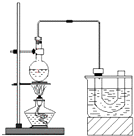 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素中,金属活泼性最强的是Li | |
| B. | 第三周期元素中,原子半径最大的是Cl | |
| C. | 短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 实验室中,可以用电石和饱和食盐水制取乙炔 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的浓溴水后过滤 | |
| D. | 分子式为C5H12O且可与金属钠放出H2的有机化合物有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羰基硫中O为-2价,C、S都是+1价 | |
| B. | 羰基硫分子中共含有3个原子核、16个电子 | |
| C. | 羰基硫分子结构中只含有极性共价键 | |
| D. | 羰基硫的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | (1) | (2) | ||||||
| 3 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 4 | (10) | (11) | (12) |
 ,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键.
,所含有的化学键为离子键、共价键,熔化时克服作用力为:离子键. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,属于取代反应;
,属于取代反应;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com