B
分析:A、体积换算物质的量,二氧化氮与水反应生成硝酸和一氧化氮,根据化学方程式计算电子转移;
B、质量换算物质的量结合过氧化钠的结构分析计算;
C、1mol碳原子和4mol碳原子形成共价键,每2mol碳原子形成1mol共价键;
D、计算氢氧根离子浓度结合体积计算物质的量,依据化学式计算钡离子.
解答:A、标况下,22.4LNO
2物质的量为1mol,发生的反应为:3NO
2+H
2O=2HNO
3+NO,3mol二氧化氮反应转移电子为2mol,所以1mol二氧化氮反应转移电子为

mol,故A错误;
B、78gNa
2O
2固体物质的量为1mol,含阴离子O
22-为1mol,故B正确;
C、3g金刚石晶体物质的量为
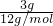
=0.25mol,含有的共价键数为0.5N
A,故C错误;
D、pH=14的Ba(OH)
2溶液中氢氧根离子浓度为0.1mol/L,含氢氧根离子物质的量为0.1mol,所以钡离子物质的量为0.05ml,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,质量换算物质的量计算微粒数,金刚石的结构特征,pH有关的计算.

 mol,故A错误;
mol,故A错误;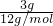 =0.25mol,含有的共价键数为0.5NA,故C错误;
=0.25mol,含有的共价键数为0.5NA,故C错误;
