
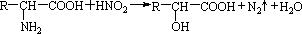
 .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为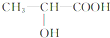 ,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为
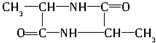
,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为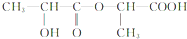 ;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为
;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为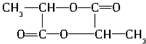 ,据此解答.
,据此解答. .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为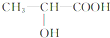 ,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为
,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为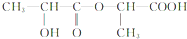 ;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为
;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为 ,
, 、
、 ,
, ;
; ;
;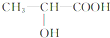
| 浓硫酸 |
| △ |
 +2H2O,
+2H2O,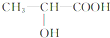
| 浓硫酸 |
| △ |
 +2H2O;
+2H2O; ,
, .
.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
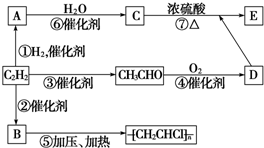
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol?L-1 |
| B、4mol?L-1 |
| C、6mol?L-1 |
| D、8mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
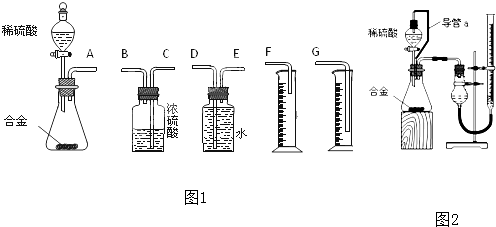
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加70℃以上的热水,分液 |
| B、加足量NaOH溶液,分液 |
| C、加适量浓溴水,过滤 |
| D、加适量FeCl3溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和体积与pH都相等的醋酸溶液和盐酸所消耗的NaOH的质量 |
| B、软水和硬水中Ca2+、Mg2+的含量 |
| C、硫酸工业中二氧化硫的催化氧化反应与合成氨生产中所采用的压强 |
| D、相同温度、相同浓度的NH4Cl和NH4HSO4溶液中c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、Ca(OH)2 |
| C、Na2 CO3 |
| D、NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此电池能发出蓝色的火焰 |
| B、氧气为正极,氢气为负极 |
| C、工作时电解液一定与H2反应 |
| D、负极:2H2+4OH--4e-═4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com