
【题目】下列关系正确的是( )
A.密度:CCl4>H2O>苯
B.同质量的物质燃烧耗 O2 量:丙炔>乙炔>甲烷
C.熔点:戊烷>2,2 -二甲基戊烷>2,3 -二甲基丁烷>丙烷
D.同物质的量物质燃烧耗 O2 量:己烷>环己烷>苯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是
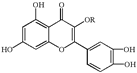
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为乙基则该物质的分子式可以表示为![]()
C.lmol该化合物最多可与![]() 完全反应
完全反应
D.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学根据课本第50页科学探究实验,用三支试管、水槽、胶塞、导管、酒精喷灯及其它必要的仪器和物品,设计了以下实验装置,完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
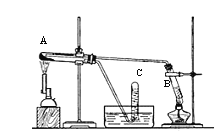
(1)写出该反应的化学方程式________。
(2)试管A中装的试剂是________ ;试管B中装的试剂是________。
(3)试管C中收集气体的方法叫作_________;收集的气体是(填化学式)_____。
(4)如果要在气体导出管口点燃该气体,则必须对该气体进行 _______。
(5)该同学欲确定反应后A试管中还原铁粉是否完全反应。设计了如下实验方案:第I步:待A试管冷却后,取少许其中的固体物质溶于稀硫酸,得溶液x;第II步:取少量溶液x滴加KSCN溶液,若溶液变红色则说明溶液x中含有_________。
①甲同学按照上述实验方案进行了实验,结果溶液未变红色,原因是(用离子方程式表示)____。
②乙同学按照上述实验方案进行了实验,结果溶液变红色。得出结论:A试管中还原铁粉反应完全。你觉得该结论是否合理?_______(填“合理”或“不合理”)请说明理由___________。(如果认为合理,此空不答。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
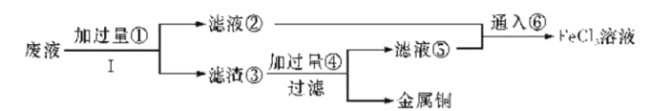
(1)写出下列物质的化学式①__、③___、⑥__。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:__。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为___色沉淀,此过程所涉及反应的化学方程式为:___、___。
(5)通入⑥发生反应的离子方程式:___。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是__(填字母代号)。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)宇航员常用过氧化钠作供氧剂,写出对应反应的化学方程__、__。
(2)新制氯水在阳光照射下容易分解产生无色气体,该反应的化学方程式是__。
工业上将氯气通入冷的消石灰制成漂白粉,写出该反应的化学方程式并用双线桥法表示电子转移的方向和数目的__。
(3)KAl(SO4)2·12H2O因其溶于水生成__(化学式)胶体可以吸附杂质,从而达到净水的目的。
(4)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是__,当反应中有1molK2FeO4生成时,消耗的Cl2在标准状况下的体积为__L,转移电子的数目为__。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是__,当反应中有1molK2FeO4生成时,消耗的Cl2在标准状况下的体积为__L,转移电子的数目为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下硫酸亚铁分解反应为2FeSO4![]() Fe2O3+SO2↑+SO3↑,下列说法不正确的是
Fe2O3+SO2↑+SO3↑,下列说法不正确的是
A.将产生的气体,通入紫色石蕊试液后溶液只变红不褪色
B.将反应后残留固体物质用盐酸溶解,再加入KMnO4溶液后褪色,说明硫酸亚铁固体分解完全
C.将少量产生的气体,分别通入含有NaOH的BaCl2溶液和含有氨水的BaCl2溶液中均产生白色沉淀,且沉淀成分相同
D.在实际实验操作过程将产生的气体通入品红溶液后溶液颜色先加深后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯、乙醛为原料,AlCl3 为催化剂制备 1,1–二苯乙烷,其反应原理为:
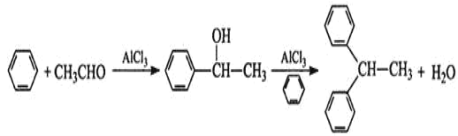
已知:AlCl3 固体遇水会发生较强烈水解。 I.制取装置如图所示。
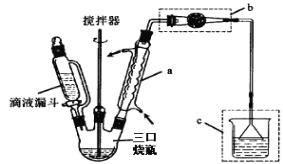
(1)该反应需控制反应温度为 20℃。控制 20℃的方法是________ ;该反应不高于 20℃ 的可能原因是:_______ 。
(2)仪器 a 的名称是 __________ 作用是 _________ ;装置 c 的作用是吸 收 HCl,写出产生 HCl 的化学方程式 ________;装置 b 的作用是 _____________ 。
Ⅱ.实验结束后,将三口烧瓶中的混合物倒入冷稀盐酸中,用分液漏斗分离出有机层,依 次用水、2%碳酸钠溶液、水洗涤,洗涤后加入少量无水硫酸镁固体,过滤、蒸馏,得到 1, 1–二苯乙烷。
(3)分液漏斗中,产品在____(填“上”或“下”)层;洗涤操作中,第二次水洗的目的 是____;无水硫酸镁也可用物质 ______________ 代替。
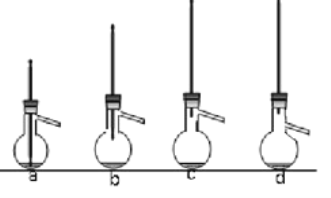
(4)蒸馏提纯时,下列装置中会导致收集到的产品中混有低沸点杂质的装置是______ (选填编号)。
(5)三口烧瓶中加入 120mL 苯(密度 0.88g/mL)、19g A1C13 和 3.7g 乙醛,20℃时充分反应, 制得纯净的 1,1–二苯乙烷 7.8g。该实验的产率约为 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,如图为海水资源利用的部分过程。
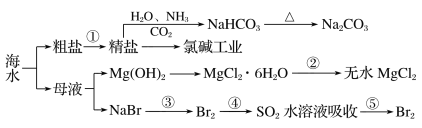
下列有关说法正确的是( )
A.用澄清石灰水可鉴别NaHCO3和Na2CO3
B.第③步和第⑤步均发生了氧化还原反应
C.在第③④⑤步中溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com