
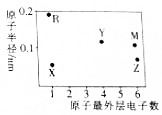
 X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )
X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )| A. | 五种元素位于同一周期 | |
| B. | 简单离子半径:M<R | |
| C. | Y、Z形成的常见化合物中存在离子键 | |
| D. | 气态氢化物的稳定性、沸点均有Z>M |
分析 X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z、M最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;由半径大小可知Y是C、Z是O、M为S元素,结合对应单质、化合物的性质解答该题.
解答 解:由以上分析可知X为H、Y为C、Z为O、M为S、R为Na,
A.X为H,位于第一周期,C、O为第二周期、Na、S为第三周期,故A错误;
B.硫离子比钠离子多一个电子层,硫离子半径较大,故B错误;
C.Y为C、Z为O,形成的化合物为共价化合物,只含有共价键,故C错误;
D.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选D.
点评 本题考查原子结构和元素周期律,为高考常见题型,侧重考查学生推断及知识综合运用、灵活运用能力,明确离子半径比较方法、氢化物稳定性的比较方法、物质结构是解本题关键,题目难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
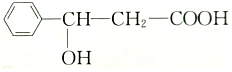 ,对该有机物的下列说法中正确的是( )
,对该有机物的下列说法中正确的是( )| A. | 含有羟基、苯基、羧基三种官能团 | B. | 属于芳香烃 | ||
| C. | 在一定条件下,能发生酯化反应 | D. | 属于羧基,也属于酚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{19}^{40}$K 与${\;}_{19}^{39}$K | B. | T2O与H2O | ||
| C. | CH3CH2CH2CH3与 | D. | CH3CH3与CH3CH3CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH$\stackrel{TiO_{2}}{→}$CH3CHO+H2↑.
纳米级TiO2是一种光催化材料,可处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:CH3CH2OH$\stackrel{TiO_{2}}{→}$CH3CHO+H2↑.查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:推断题
(1)石油裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产化工产品的转化关系图。
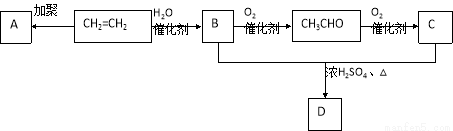
填写下列各空:
CH2=CH2  B的反应类型: ,
B的反应类型: ,
②A的结构简式: ,
③B+C D反应的化学方程式: ,
D反应的化学方程式: ,
④区别乙烯和乙烷时,可将两种气体分别通入 中,观察溶液变化。
(2)(某研小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
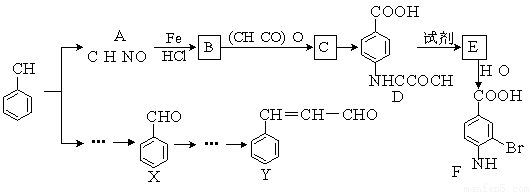
已知:①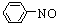
2CH3CHO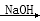 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO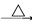 CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
①下列有关F的说法正确的是 ;
A.分子式是C7H7NO2Br B.能形成内盐
C.能发生取代反应和缩聚反应 D.1 mol的 F最多可以和2 mol NaOH反应
②C→ D的反应类型是 ;
③在合成F的过程中,B→C步骤不能省略,理由是 ;
④写出同时符合下列条件的A的一种同分异构体的结构式 ;
Ⅰ苯环上只有两种不同化学环境的氢原子 Ⅱ分子中含有 -CHO
⑤以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO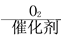 CH3COOH
CH3COOH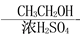 CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:



X Z
下列有关叙述中不正确的是( )
A.Z结构中有4个手性碳原子
B.Y的分子式为C9H8O3
C.1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH
D.Z与浓溴水既能发生取代反应又能发生加成反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:实验题
某同学按下列步骤配制500 mL 0.20 mol·L-1KCl溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需KCl的质量 |
|
(2)称量KCl固体 | 称量过程中主要用到的仪器是__________ |
(3)将KCl加入100 mL烧杯中,加适量蒸馏水溶解 |
|
(4)将烧杯中的溶液转移至500 mL容量瓶中,洗涤2至3次并将洗涤液转入容量瓶中 | 为防止溶液溅出,应该采取的措施是______________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______________________________ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
Ⅰ.反应:aA(g) + bB(g)  cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
cC(g) △H<0 在2L恒容容器中进行。改变其他反应条件,在第一、第二和第三阶段体系中各物质的物质的量随时间变化的曲线如图所示:
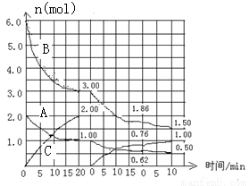
回答问题:
(1)反应的化学方程式中,a:b:c == 。
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)比较第二阶段反应温度(T2)和第三阶段反应温度(T3)的高低:T2 T3(填“>”“<”或“=”),判断的理由是 。
(4)第三阶段平衡常数K3的计算式 。
Ⅱ.利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体。
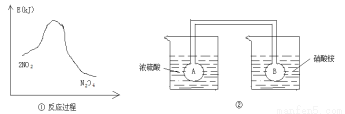
(5)B瓶中的气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com