
| A. | CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 | |
| D. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
分析 A.醋酸钠溶液中滴入浓盐酸反应生成醋酸;
B.浓氨水中滴入氯化铁饱和溶液生成氢氧化铁沉淀;
C.Cu(NO3)2溶液中铜离子会抑制沉淀溶解平衡的右移;
D.FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发得到氢氧化铁,灼烧得到氧化铁,硫酸铁水溶液中水解生成氢氧化铁和硫酸,加热蒸发式蒸发水,平衡逆向进行,得到硫酸铁;
解答 解:A.醋酸钠中加入盐酸会发生反应生成醋酸和氯化钠,所以醋酸根离子浓度会减小,故A错误;
B.浓氨水和氯化铁之间会发生复分解反应生成氢氧化铁沉淀和氯化铵,不会获得胶体,应是沸水中滴加饱和氯化铁溶液加热到红褐色得到氢氧化铁胶体,故B错误;
C.氢氧化铜存在沉淀溶解平衡Cu(OH)2?Cu2++2OH-,Cu(NO3)2溶液中铜离子会抑制沉淀溶解平衡的右移,所以Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度,故C正确;
D.在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热发生2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,Fe2(SO4)3溶液中存在水解平衡,Fe2(SO4)3+6H2O?2Fe(OH)3+3H2SO4,加热蒸发,被蒸出的是水,平衡逆向进行,得到硫酸铁,灼烧不能得到氧化铁,故D错误;
故选C.
点评 本题考查学生物质的性质以及沉淀溶解平衡的影响因素等方面的知识,注意知识的归纳和整理是解题关键,难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的任何物质,其物质的量一定相等 | |
| B. | 等质量的SO2和SO3中所含硫原子数相等 | |
| C. | 1L氮气一定比1L氧气的质量小 | |
| D. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同


| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5)(8) | D. | (1)(2)(5)(8) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
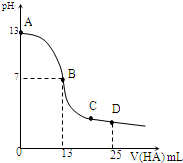 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、CO32-、NO3- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x﹕m﹕n=1﹕2﹕1 | B. | m﹕n=2﹕1 | C. | m≥2x+2 | D. | m<2x+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
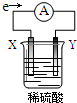 在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列说法正确的是( )
在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | X极上发生的是还原反应 | |
| C. | 溶液中氢离子向X极移动 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com