
| A. | 已知H+(aq)+OH-(aq)═H20(l)△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-2×(-57.3)kJ•mol-1 | |
| B. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2kJ/mol可知,红磷比白磷稳定 | |
| C. | H2(g)的燃烧热是285.8kJ•mol-1,则2H2O═2H2(g)+O2(g)△H=+571.6KJ•mol-1 | |
| D. | 恒温恒容时,将2molA和1molB投入密闭容器中,发生反应:2A(g)+B(g)?2C(g).充分反应后测得放出的热量为QkJ,则该反应的△H=-QkJ/mol |
分析 A.硫酸与氢氧化钡反应除了生成水,还生成了硫酸钡沉淀,放出的热量增大;
B.物质具有能量越高,物质稳定性越弱;
C.该热化学方程式中没有指出水的状态;
D.该反应为可逆反应,反应物不可能完全转化成生成物.
解答 解:A.已知H+(aq)+OH-(aq)═H20(l)△H=-57.3kJ•mol-1,由于H2SO4和Ba(OH)2反应中生成2mol水和1mol硫酸钡,则该反应的反应热△H≠-2×(-57.3)kJ•mol-1,故A错误;
B.由4P(s,红磷)═P4(s,白磷)△H=+139.2kJ/mol可知,红磷具有能量小于白磷,则红磷比白磷稳定,故B正确;
C.H2(g)的燃烧热是285.8kJ•mol-1,则2mol液态水分解生成氢气和氧气吸收571.6kJ热量,正确的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6KJ•mol-1,故C错误;
D.恒温恒容时,将2molA和1molB投入密闭容器中,发生反应:2A(g)+B(g)?2C(g),充分反应后测得放出的热量为QkJ,2molA完全反应放出热量大于QkJ,焓变为负值,则该反应的△H<-QkJ/mol,故D错误;
故选B.
点评 本题考查较为综合,涉及反应热与焓变、化学方程式、物质稳定性判断,题目难度中等,明确化学反应与能力变化的关系为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
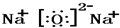 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
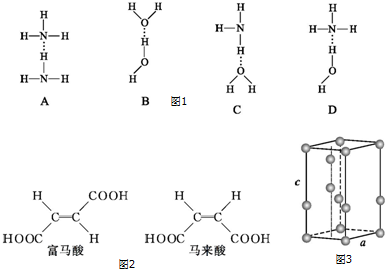
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
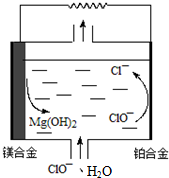
| A. | Mg-Li合金比传统的Mg-Al合金具有更高的比能量 | |
| B. | 铂合金的电极反应:ClO-+H2O═Cl-+2OH--2e-,OH-向镁合金电极迁移 | |
| C. | 该电池镁合金会发生自身腐蚀产生氢气,使电极利用率降低 | |
| D. | 把电解质换成H2O2、H2SO4和NaCl的混合溶液,工作时H2O2将参与电极反应,其电极反应为:2H2O2-2e-═O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验操作 | 实验现象及结论 |
| 将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
| 将浸有酚酞溶液的滤纸湿润后,放入盛有干操氨气的集气瓶中 | 滤纸变红,说明氨气遇水形成溶液呈碱性 |
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅,最后褪为无色 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中的NaOH溶液倒吸入Y管中 | ④该反应是气体体积减小的反应,Y管内压强降低,在大气压的作用下发生倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子能透过滤纸,但不能透过半透膜 | |
| B. | 胶体和溶液的本质区别在于分散质粒子大小 | |
| C. | 蛋清、豆浆、墨水都是胶体 | |
| D. | 丁达尔效应是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com