
常温下,下列各组离子能大量共存的是
A.pH=12的溶液中:K+、Na+、Br-、AlO2-
B.无色溶液中:H+、K+、MnO4-、C2O42-
C.c(Fe3+)=0.1mol/L的溶液中:K+、H+、SCN-、I-
D.由水电离出的c(OH-)=1.0×10-13mol/L的溶液中:Na+、NH4+、SO42-、HCO3-
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA | |
| D. | 0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列有关二甲醚的叙述正确的是( )
.下列有关二甲醚的叙述正确的是( )| A. | 二甲醚是一种有机物,属于非电解质 | |
| B. | 4.6g该物质中含有共价键的数目为2×6.02×1022 | |
| C. | 二甲醚和乙醇互为同分异构体且和甲醇互为同系物 | |
| D. | 标准状况下,燃烧11.2L二甲醚一定生成22.4LCO2 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变成棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化,下列说法不正确的是
A.上述过程中,最终被还原的是NO3-
B.从上述反应可以得出结论,氧化性:HNO3>Fe3+>稀硫酸
C.上述过程中,会产生一种无色难溶于水的气体
D.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为1∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:实验题
如下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol·L-1的稀盐酸。
①该学生需要用量筒量取________mL浓盐酸进行配制。
②实验所用仪器除了烧杯、玻璃棒、量筒还需要用到的玻璃仪器有
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol·L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取________mL盐酸。(精确到小数点后一位)
②假设该同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因 是________。
是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
VLFe2(SO4)3溶液中含有agSO42﹣,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A.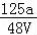 mol/L
mol/L
B.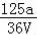 mol/L
mol/L
C.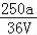 mol/L
mol/L
D.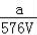 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:实验题
某强碱性溶液中可能含有的离子是K+、NH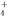 、Al3+、AlO
、Al3+、AlO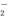 、SO
、SO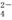 、SiO
、SiO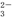 、CO
、CO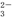 、Cl-中的某几种离子,现进行如下实验:
、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成;
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在 的离子是,肯定不存在的离子是。
的离子是,肯定不存在的离子是。
(2)已知一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl- ?。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH-=H2O②
③
④HCO3-+H+=H2O+CO2↑
⑤
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的K=6.82×10-6moL-2•L-2则所含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6moL2-•L-2 | |
| B. | 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 | |
| C. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3 | |
| D. | 用石灰水处理含有Mg2+和HCO3的硬水,发生的离子反应的方程式为Mg2++2HCO3+Ca2+2OH═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com