
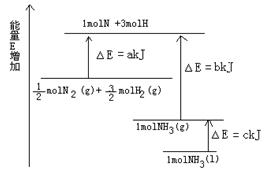
 ________________。
________________。科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1 CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1| A.加入某物质作催化剂 | B.加入一定量CO |
| C.反应温度降低 | D.增大容器体积 |
 CH3OCH3(g)+CO2(g)的△H= ;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H= ;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。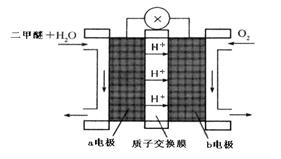
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是( )
2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是( )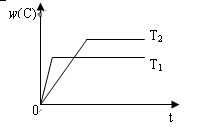
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④⑤ | B.②④⑤⑦ | C.①④⑤③ | D.②④⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A的能量一定高于C |
| B.B的能量一定高于D |
| C.A和B的能量总和一定高于C和D的能量总和 |
| D.因该反应为放热反应,故不必加热就可自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.2A(g)+B(g) ="==" 2C(g) △H<0 | B.2A(g)+B(g) ="==" 2C(g) △H>0 |
| C.2A+B="==" 2C △H<0 | D.2C="==" 2A+B △H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com