
| A. | 常温下,测得醋酸钠溶液的pH>7 | |
| B. | 醋酸可以使紫色石蕊试液变红 | |
| C. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比与醋酸反应的快 | |
| D. | 常温下,测得0.1 mol/L醋酸溶液的pH>1 |
分析 要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.常温下,测得醋酸钠溶液的pH>7,说明醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则证明醋酸是弱酸,故A不选;
B.醋酸可以使紫色石蕊试液变红色,说明醋酸电离出氢离子而使溶液呈酸性,但不能说明醋酸是否部分电离,所以不能证明醋酸是弱电解质,故B选;
C.物质的量浓度相同时,锌粒跟盐酸反应的速率比与醋酸反应的快,说明盐酸中氢离子浓度大于醋酸,二者都是一元酸,HCl是强电解质,则醋酸是弱电解质,故C不选;
D.常温下,测得0.1 mol/L醋酸溶液的pH>1,醋酸中氢离子浓度小于醋酸浓度,说明醋酸部分电离,为弱电解质,故D不选;
故选B.
点评 本题考查弱电解质的判断,为高频考点,强弱电解质的根本区别是电离程度,与其溶液导电性强弱、溶解性强弱等都无关,注意把握实验原理和角度.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑥ | C. | ③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
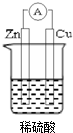 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水的反应Na+H2O=Na++OH-+H2↑ | |
| B. | 氯气通入水中Cl2+H2O=2H++Cl-+ClO- | |
| C. | 小苏打溶液中加入过量的石灰水Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 碳酸钙和醋酸CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应物的总键能量低于生成物的总键能 | |
| B. | 该反应是放热反应 | |
| C. | 当A的正反应速率与C的逆反应速率相同时处于平衡状态 | |
| D. | 当A、B、C、D的浓度相同时,反应处于平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com