
【题目】(1)在25℃、101 kPa下,1 6g甲醇(![]() )燃烧生成CO2和液态水时放热362.88 kJ。则表示甲醇燃烧热的热化学方程式为 。
)燃烧生成CO2和液态水时放热362.88 kJ。则表示甲醇燃烧热的热化学方程式为 。
(2)已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g)△H=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 。
SO3(g)△H=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 。
【答案】![]()
<196.64KJ
【解析】
试题分析:(1)16g甲醇燃烧生成CO2和液态水时放热362.88kJ,16g甲醇的物质的量为16g ÷ 32 g/mol = 0.5mol,1mol甲醇燃烧生成CO2和液态水时放热362.88kJ×2=725.76kJ,表示甲醇燃烧热的热化学方程式为:![]()
(2)已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g)△H=―98.32kJ/mol,所以1molSO2与0.5molO2完全,放出热量98.32kJ,SO2和O2反应为可逆反应,容器中充入2molSO2和1molO2,SO2和O2不能完全反应,反应的SO2物质的量小于2mol,所以放出的热量小于98.32kJ×2=196.64kJ.
SO3(g)△H=―98.32kJ/mol,所以1molSO2与0.5molO2完全,放出热量98.32kJ,SO2和O2反应为可逆反应,容器中充入2molSO2和1molO2,SO2和O2不能完全反应,反应的SO2物质的量小于2mol,所以放出的热量小于98.32kJ×2=196.64kJ.


科目:高中化学 来源: 题型:
【题目】下列关于化学电源的叙述错误的是( )
A. 普通锌锰干电池中碳棒为正极
B. 铅蓄电池中覆盖着PbO2的电极板是负极板
C. 氢氧燃料电池的正极是通入氧气的那一极
D. 碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与安全事故处理错误的是
A. 使用水银温度计测量烧杯中的水的温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
B. 试管夹从试管底由下往上夹住试管口约![]() 处,手持试管夹长柄末端进行加热
处,手持试管夹长柄末端进行加热
C. 燃着的酒精灯翻倒,酒精洒到桌面并且燃烧,为了人身安全,应立即撤离现场
D. 将玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端并缓慢旋进塞孔中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列化学方程式或离子方程式
(1)金属铝与氢氧化钠溶液反应_______________________
(2)工业用焦炭与二氧化硅制粗硅_______________________
(3)金属铝与氧化铁的铝热反应_______________________
(4)Na2O2与水反应的离子方程式_______________________
(5)氯化亚铁溶液与氯气反应的离子方程式_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3合并配成溶液,向溶液中滴加0.lmol·L—l的盐酸。下图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
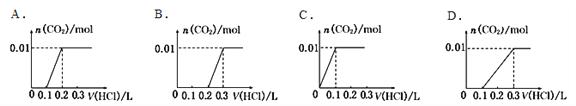
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 通过石油分馏可以获得大量的芳香烃
B. 石油裂化的目的是为了得到乙烯、丙烯和苯
C. 煤的干馏发生了化学变化
D. 煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH= 。
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:

① 用H2 表示前2 h平均反应速率v(H2)= 。
② 该温度下CO2的平衡转化率为 。
(3)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() CH4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
CH4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:

①该反应的ΔH 0(填“>”、“=”或“<”)。
②曲线c表示的物质为 。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是 ,用平衡移动原理说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:
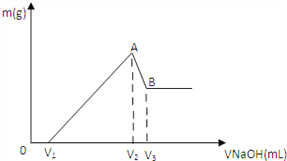
(1)写出A→B段反应的离子方程式_____________。
(2)A点沉淀的总物质的量n= _________________。
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积为多少___________mL?(写出计算过程,下同)
(4)若V1=60mL,则混合物中Mg的物质的量为多少___________? V3点所加NaOH溶液的体积为多少___________mL?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Al、Fe二种金属元素,下列说法正确的是
A. 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼
B. 等物质的量的Al、Fe分别与足量盐酸反应放出等质量的H2
C. 二者的氢氧化物都不可以通过氧化物化合反应直接制备
D. 二者的单质都能与强碱溶液反应生成H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com