
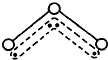
 O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
| A、①③④ | B、②⑥⑦ |
| C、③④⑤ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
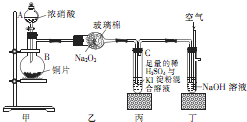 某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题
某学校化学学习小组为探究二氧化氮的性质,按图所示装置进行实验.请回答下列问题| 装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
| 乙 | 淡黄色固体变白色 | Na2O2+2NO2═2NaNO3 | |
| 丙 | 氧化性 |
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测溶液于试管A中,加入几滴 |
|
| 步骤② | |
|
| 步骤③ | 另取少量待测溶液于试管C中,加入足量氯水,再加入四氯化碳,静置后观察颜色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应 | A | B | C | D |
| △H/kJ?mol-1 | 10.5 | 1.80 | -126 | -11.7 |
| △S/J?mol-1?K-1 | 30.0 | -113.0 | 84.0 | -105.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流大小/?A |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹 果 | 2 | 27.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜镀层放出2.24L H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com