
分析 (1)相同条件下,密度之比等于相对分子质量之比,据此计算混合气体的相对分子质量,进而确定含有的烷烃;
(2)根据n=$\frac{V}{{V}_{m}}$计算56L混合气体的物质的量,再根据m=nM计算混合气体的质量,溴水质量增重35.0g为烯烃的质量,进而计算烷烃的质量与物质的量,再计算烯烃的物质的量,据此解答;
(3)由烯烃的质量与物质的量,根据M=$\frac{m}{n}$计算其摩尔质量,据此计算烯烃的分子式,书写可能的结构.
解答 解:(1)在同温同压下,混合气体对氢气的相对密度为13,故混合气体的平均相对分子质量为13×2=26,故一定含有甲烷,
故答案为:CH4;
(2)标况下56L混合气体的物质的量为:$\frac{56L}{22.4L/mol}$=2.5mol,故混合气体的总质量为2.5mol×26g/mol=65g,溴水质量增重35.0g为烯烃的质量,故甲烷的质量为65g-35g=30g,故甲烷的物质的量为:$\frac{30g}{16g/mol}$=$\frac{15}{8}$mol,烯烃的物质的量为2.5mol-$\frac{15}{8}$mol=$\frac{5}{8}$mol,故n(CH4):n(C4H8)=$\frac{15}{8}$mol:$\frac{5}{8}$mol=3:1,
故答案为:3:1;
(3)烯烃的摩尔质量为:$\frac{35g}{\frac{5}{8}mol}$=56g/mol,设烯烃的组成为(CH2)n,故14n=56,解得n=4,故该烯烃为C4H8,可能的结构为:CH2=CH-CH2CH3、CH3-CH=CH-CH3、CH2=C(CH3)2,
故答案为:CH3CH2CH=CH2、CH3CH=CHCH3、(CH3)C=CH2.
点评 本题考查混合物反应的计算、有机物分子式、结构简式的确定,题目难度中等,根据平均相对分子质量确定含有甲烷是解题的关键,试题培养了学生的分析能力及化学计算能力.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
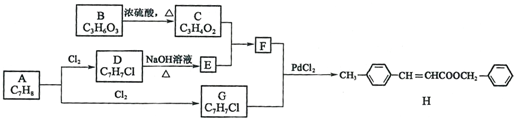
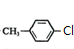 .
. .
.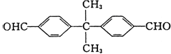 、
、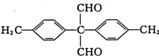 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取10.00 mL 1.0mol•L-1的盐酸于100mL容量瓶中,加水定容至刻度,可配得0.1mol•L-1的盐酸 | |
| B. | 做焰色反应时,若连续做两个样品,应将铂丝用硫酸洗净并灼烧到无色 | |
| C. | 取试样与氢氧化钠浓溶液共热,产生能使湿润红色石蕊试纸变蓝色的气体,则说明试样中有NH4+ | |
| D. | 直接用分液的方法分离乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
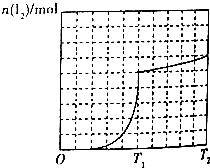 H2O2与KI的酸性溶液反应生成I2的物质的量与温度的关系如图所示(0-T1,T1~T2所用时间相等),下列有关说法正确的是( )
H2O2与KI的酸性溶液反应生成I2的物质的量与温度的关系如图所示(0-T1,T1~T2所用时间相等),下列有关说法正确的是( )| A. | 由于温度升高,反应速率加快,所以T1~T2时段生成I2的反应速率大于0~T1时段 | |
| B. | 由于H2O2分解速率加快,浓度快速减小,所以T℃后升温,生成I2的反应速率变小 | |
| C. | 由上述反应原理可知不能用H2O2除去KCl溶液中少量的HI杂质 | |
| D. | 由图象可知该反应正向为放热反应& |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化过程都有化学变化 | |
| B. | 防腐剂福尔马林(含甲醛)可用作食品保鲜剂 | |
| C. | 用碘酒滴加在阿斯匹林、去痛片等药片上,可检验药片是否含有淀粉 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com