
A、 测定乙醇结构式 |
B、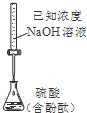 测定硫酸浓度 |
C、 合成并检验氨 |
D、 分离并回收硝基苯中的苯 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:



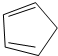 与CH≡CH(乙炔)也能发生Diels-Alder反应,请写出该反应产物的结构简式
与CH≡CH(乙炔)也能发生Diels-Alder反应,请写出该反应产物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的PH值 | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2( Al2O3):加NaOH溶液后过滤 |
| B、Br2(CCl4):蒸馏 |
| C、FeCl2(FeCl3):加铁屑后过滤 |
| D、CO(CO2):用NaOH溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉和纤维素是同分异构体 |
| B、淀粉、蛋白质、油脂都属于天然高分子化合物 |
| C、植物油不能使溴的四氯化碳溶液褪色 |
| D、油脂在酸性条件下水解与在碱性条件下水解,产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子或分子结构、单质或化合物相关信息 | |
| X | 含X元素的物质焰颜色反应为黄色 |
| Y | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
| Z | Z元素原子易失去2个电子形成8电子结构的离子 |
| M | M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com