
����Ŀ���Ȼ�隣������̿��Ʊ��ߴ���̼���̵Ĺ����������£�
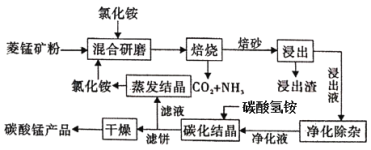
��֪�������̿�ʯ��Ҫ�ɷ���MnCO3������������Fe��Al��Ca��Mg��Ԫ�أ�
�������£�CaF2��MgF2���ܶȻ��ֱ�Ϊ1.46��10-10��7.42��10-11
����ؽ�������c(Mn+)=0.1mol/L�γ������������ʱ��pH���£�
�ش��������⣺
�������� | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
��ʼ������pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
������ȫ��pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)��������ʱ��������Ҫ��ѧ��Ӧ����ʽΪ______________________��
(2)��������ͼ1��ͼ2��ͼ3���Ȼ�隣�����þ�����������ǣ�
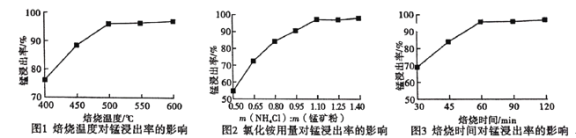
�����¶�_________���Ȼ������þ��۵�����֮��Ϊ__________������ʱ��Ϊ___________.
(3)����Һ�������������������£����ȼ���MnO2��Fe2+����ΪFe3+����Ӧ�����ӷ���ʽΪ________��Ȼ�������ҺpHʹFe3+��Al3+������ȫ����ʱ��Һ��pH��ΧΪ____���ټ���NH4F����Ca2+��Mg2+����c(Ca2+)=1.0��10-5mol/Lʱ�� c(Mg2+)=______mol/L
(4)̼���ᾧʱ��������Ӧ�����ӷ���ʽΪ_____________________________________________��
(5)��������ѭ�����õĹ�̬������____________��
���𰸡�MnCO3+2NH4Cl![]() MnCl2+2NH3��+CO2��+H2O 500�� 1.10 60min MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2��pH<8.8 5��10-6 Mn2++2HCO3-
MnCl2+2NH3��+CO2��+H2O 500�� 1.10 60min MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2��pH<8.8 5��10-6 Mn2++2HCO3-![]() MnCO3��+CO2��+H2O NH4Cl
MnCO3��+CO2��+H2O NH4Cl
��������
�������̣�����þ���(��Ҫ�ɷ���MnCO3������������Fe��Al��Ca��Mg��Ԫ��)��NH4Cl�����ĥ���գ�����MnCO3��2NH4Cl ![]() MnCl2��2NH3����CO2����H2O������������Һ�к���Mn2����Fe2����Al3����Ca2����Mg2��������MnO2��Fe2��������Fe3����MnO2��2Fe2����4H��=Mn2����2Fe3����2H2O��Ȼ�����pH��Χ��5.2��pH<8.8��ʹ Fe3����Al3���������������ʽ��ȫ�������ټ���NH4F����Ca2����Mg2�������ˣ�����Һ�ɷ���Ҫ��MnCl2������̼�����̼���ᾧ��������Ӧ��Mn2����2HCO3��
MnCl2��2NH3����CO2����H2O������������Һ�к���Mn2����Fe2����Al3����Ca2����Mg2��������MnO2��Fe2��������Fe3����MnO2��2Fe2����4H��=Mn2����2Fe3����2H2O��Ȼ�����pH��Χ��5.2��pH<8.8��ʹ Fe3����Al3���������������ʽ��ȫ�������ټ���NH4F����Ca2����Mg2�������ˣ�����Һ�ɷ���Ҫ��MnCl2������̼�����̼���ᾧ��������Ӧ��Mn2����2HCO3��![]() MnCO3����CO2����H2O�����ˣ��õ�MnCO3��Ʒ����ҺNH4Cl������ҺNH4Cl�����ᾧ�õ�NH4Cl��ѭ��ʹ�ã��ݴ˷�������
MnCO3����CO2����H2O�����ˣ��õ�MnCO3��Ʒ����ҺNH4Cl������ҺNH4Cl�����ᾧ�õ�NH4Cl��ѭ��ʹ�ã��ݴ˷�������
��1��������MnCO3��NH4Cl�ķ�Ӧ����������ͼ���õ�������CO2��NH3������Ԫ���غ㣬��˷���ʽΪMnCO3��2NH4Cl![]() MnCl2��2NH3����CO2����H2O��
MnCl2��2NH3����CO2����H2O��
��ΪMnCO3��2NH4Cl![]() MnCl2��2NH3����CO2����H2O��
MnCl2��2NH3����CO2����H2O��
��2������ͼ1���¶���500��ʱ�����ʽϸߣ�����������¶ȣ����������Ӳ�����߳ɱ�������ͼ2���Ȼ������þ��������Ϊ1.10ʱΪ��ѣ�����ͼ3����60minʱ������Ϊ��ѣ�
��Ϊ500�棻1.10��60min��
��3��MnO2��Fe2��������Fe3������������ԭΪMn2�������ݻ��ϼ�������������ƽ�������ӷ���ʽΪMnO2��2Fe2����4H��=Mn2����2Fe3����2H2O������pHʹFe3����Al3��������ȫ��������Ӱ��Mn2�������pH������5.2��pH<8.8������NH4F����ȥMg2����Ca2��������Һ��c(Ca2��)=1.0��10��5mol��L��1ʱ����Һ��c2(F��)=![]() =1.46��10��5mol��L��1������Һc(Mg2��)=
=1.46��10��5mol��L��1������Һc(Mg2��)=![]() ��5��10��6mol��L��1��
��5��10��6mol��L��1��
��ΪMnO2��2Fe2����4H��=Mn2����2Fe3����2H2O��5.2��pH<8.8��5��10��6mol��L��1��
��4����������ͼ��̼���ᾧ�õ�MnCO3����̼���ᾧ��ԭ����Mn2����NH4HCO3��������MnCO3���÷�Ӧ��û�л��ϼ۱仯��������������ԭ��Ӧ�������ӷ���ʽΪMn2����HCO3��![]() MnCO3����CO2����H2O��
MnCO3����CO2����H2O��
��ΪMn2����HCO3��![]() MnCO3����CO2����H2O��
MnCO3����CO2����H2O��
��5����̼���ᾧ������ˣ��õ�MnCO3��Ʒ����ҺNH4Cl������ҺNH4Cl�����ᾧ�õ�NH4Cl��ѭ��ʹ�ã�
��ΪNH4Cl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2A��B = 3C��4D(���ʾ�Ϊ����)�У���ʾ�÷�Ӧ����������(����)
A.v(A)��0.5 mol��L��1��s��1B.v(B)��0.3 mol��L��1��s��1
C.v(C)��0.8 mol��L��1��s��1D.v(D)��4 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��һ��ij��ͬѧ������ʵ��̽��Fe2+��Fe3+�����ʡ��ش��������⣺
��1������ͬѧȡ2mLFeCl2��Һ�����뼸����ˮ���ټ���1��KSCN��Һ����Һ��죬˵��Cl2�ɽ�Fe2+������FeCl2��Һ����ˮ��Ӧ�����ӷ���ʽΪ_______��
��2������ͬѧ��Ϊ�����ʵ�鲻���Ͻ�������ͬѧ��2mLFeCl2��Һ���ȼ���0.5mLú�ͣ�����Һ�������μ��뼸����ˮ��1��KSCN��Һ����Һ��죬ú�͵�������________��
����������ҵ����ij����������Cu2O��Al2O3��Fe2O3��SiO2����ȡͭ�IJ����������£���������E������ҺC��ȡ����
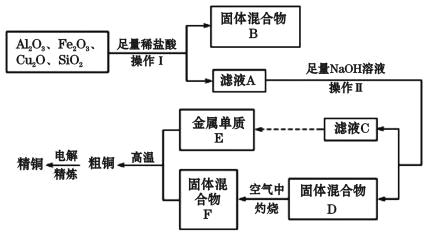
��֪��Cu2O+2H+ =Cu+Cu2+ +H2O��
��3����������B�ijɷ���____��
��4����ҺA����Ԫ�صĴ�����ʽΪ____�������ӷ��ţ������ɸ�������FeԪ�ص��йط�Ӧ�����ӷ���ʽΪ_________��_____��
��5������ҺC��ͨ������CO2���壬����CO2+OH-=HCO3-����Ҫ�����ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������𡢵������������صĽṹ�����ڽ��ʯ���۵��������ʾ��
���� | BN | AIN | GaN |
�۵�/�� | 3000 | 2200 | 1700 |
�Դӽṹ�ĽǶȷ��������۵㲻ͬ��ԭ��___________________________________��
��2��N��P��Asλ��ͬһ���壬��̬��ԭ�ӵĺ����________�ֲ�ͬ�˶�״̬�ĵ��ӣ���PO43-��Ϊ�ȵ�����ķ�����________________����һ�ּ�������
��3����ԭ�ӵ�����ܲ������_______����۵��ӹ����ʾʽΪ____________________��
��4���Ƚϵڶ�������Cu_______Zn(����>������=������<")��
��5��AuCl3��һ�ֺֺ�ɫ���壬��ʪ�Լ�ǿ��������ˮ���Ҵ��������ǹ�̬��������̬���������Զ�����Au2Cl6����ʽ���ڡ�д��Au2Cl6�Ľṹʽ__________________________.
��6����֪Zn2+��Au+������CN-�γ������ӣ� Zn2+��CN-�γɵ�������Ϊ����������,Au+��CN-�γɵ�������Ϊֱ����. ��ҵ�ϳ���Au+��CN-�γɵ���������Zn���ʷ�Ӧ����ȡAu���ʣ�д���÷�Ӧ�����ӷ���ʽ___________________________________________________________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ�������ԭ�ϣ����Ʊ�������������ת����ϵ��ͼ��

��֪��H2C=CH��OH���ȶ�
I �ٵķ�Ӧ������___����д����ϩ����������_____�� ��A����B�Ļ�ѧ����ʽ_____��
II ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A�з���Ũ���ᣬB�з����Ҵ�����ˮ�����ƣ�D�з��б���̼������Һ��

��֪������ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6C2H5OH��
���й��л���ķе���±���
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е�(��) | 34.7 | 78.5 | 118 | 77.1 |
��ش�
(1)Ũ���������Ϊ_______������ͬλ��18Oʾ�ٷ�ȷ����Ӧ����ˮ��������ԭ�ӵ��ṩ�ߣ�д���ܱ�ʾ18Oλ�õĻ�ѧ����ʽ__________
(2)���θ����C��������______����ӦǰD�м��뼸�η�̪����Һ�ʺ�ɫ����Ӧ������D�е�������________��
(3)��D�з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ�����ˮ�Ȼ��ƣ������________���ټ���(�˿մ�����ѡ����ѡ��)________��Ȼ����������ռ�77�����ҵ���֣��Եõ��ϴ���������������
A ���������� B ��ʯ��
C ��ˮ������ D ��ʯ��
(4)����ɫ��ѧ�ĽǶȷ�����ʹ��Ũ������������������֮����Ҫ��________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д������ĵ��뷽��ʽ��_____________________________________��
��2��д���������ƽ�ⳣ������ʽ��_______________��
��3����0.1mol/L ������Һ�м���ˮ������ƽ����_______�ƶ� (����������������) ��n(CH3COOH)_______�� c(CH3COO��)/c(H+)_______������������������С����������������
��4��500mL 0.1mol/L ������Һa��500mL 0.1mol/L ������Һb������Zn�۷�Ӧ����ʼ����a___b������H2����a____b����ȫ�к��������ᣬ����NaOH����a___b������<������>������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ϊȼ�ϵ�ص�ԭ�ϡ�ͨ�����з�Ӧ�����Ʊ��״���CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) ��H ����90.8 kJ��mol��1����һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 mol H2��CO ��ƽ��ת�������¶���T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
CH3OH ( g ) ��H ����90.8 kJ��mol��1����һ�ݻ��ɱ���ܱ������г���10 mol CO ��20 mol H2��CO ��ƽ��ת�������¶���T����ѹǿ��P���ı仯��ͼ��ʾ�����ﵽƽ��״̬A ʱ�����������Ϊ20 L��
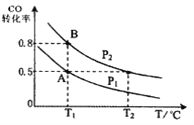
��1��T1����Ӧ��ƽ�ⳣ��Ϊ_______________��
��2��ͼ��P1 _______ P2������>������<������=������
��3���練Ӧ��ʼʱ�Գ���10 mol CO��20 mol H2������ƽ��״̬Bʱ���������V(B)=__________L��
��4�����ڷ�ӦCO(g)+2H2(g)![]() CH3OH(g)�ڻ�ѧƽ��״̬Bʱ��������ȷ����___
CH3OH(g)�ڻ�ѧƽ��״̬Bʱ��������ȷ����___
A��CO�ĺ������ֲ���
B��������CH3OHŨ����COŨ�����
C��2v��(CH3OH)= v��(H2)
D�������л�������ƽ����Է����������ֲ���
��5����֪CO2(g)+H2(g) ![]() CO(g) + H2O(g) ��H = + 41.3 kJ��mol��1 ����д����CO2��H2��ȡ�״����Ȼ�ѧ����ʽ___________________________________��
CO(g) + H2O(g) ��H = + 41.3 kJ��mol��1 ����д����CO2��H2��ȡ�״����Ȼ�ѧ����ʽ___________________________________��
��6����CH3OH��O2��ϡH2SO4���ȼ�ϵ�أ�д���õ�������ĵ缫��Ӧʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹż��еļ���˵������ȷ����
A. �����ݸ�Ŀ�����վ�����Ŀ��д����Ԫʱʼ���䷨����Ũ�ƺ�����굣���������������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ����
B. �����ϴ���������ࡷ������(��ͭ)�����ᣬ����������� �����˺Ͻ�Ӳ�ȷ��������
C. �����ݾ���ע���й��ڼ�����ʯ(KNO3)������(Na2SO4)�ļ��أ����Ի���֮����������������ʯҲ�����÷���Ӧ������ɫ��Ӧ
D. ������������ƪ���м��أ�����ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ�����ù��̷����˷ֽ⡢���ϡ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ָ�����л�ѧ��Ӧ����(�������������ӳɡ�ȡ��)
(1)CH2Cl2��Br2![]() CHBrCl2��HBr _____________
CHBrCl2��HBr _____________
(2)CH2=CH2+Br2��CH2BrCH2Br __________
(3)![]() +HNO3
+HNO3![]()
![]() NO2 +H2O _______________
NO2 +H2O _______________
(4)![]() ___________
___________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com